
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH |
| ③沉淀 |
 Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;| 3 |
| ||
| 10 -14 |
| 10 -9 |


科目:高中化学 来源: 题型:
| A、②>①>⑤>④>③ |
| B、②>①>⑤>③>④ |
| C、②>⑤>①>③>④ |
| D、②>⑤>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酚类化合物有毒,不能用于杀菌消毒 |
| B、乙二醇可用于配制汽车防冻液 |
| C、部分卤代烃可用作灭火剂 |
| D、甲醛的水溶液(福尔马林)可用于防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
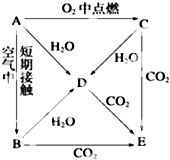 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,D焰色反应为黄色火焰.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质,D焰色反应为黄色火焰.查看答案和解析>>
科目:高中化学 来源: 题型:
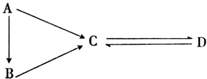 A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质.
A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,混合气体的颜色变浅 |
| B、通入NO2,化学平衡常数增大 |
| C、通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D、增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、②③④ |
| C、③④⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
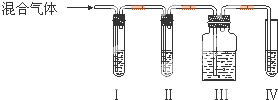 实验室制乙烯,常常因为温度过高而使乙醇与浓硫酸反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.
实验室制乙烯,常常因为温度过高而使乙醇与浓硫酸反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com