
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是
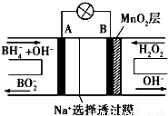
A.电极B材料中含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应:BH4-+8OH--8e-→BO2-+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L6mol/LH2O2溶液,理论上流过电路中的电子为6NA个
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
在密闭容器中A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)表示。已知υ(A)、υ(B)、υ(C)之间有以下关系2υ(B)==3υ(A),3υ(C)==2υ(B)。则此反应可表示为
A.2A+3B==2C B.A+3B== 2C
C.3A+B==2C D.A+B==C
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:选择题
将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各0.075 mol
B.稀硝酸的物质的量浓度为2.0 mol·L-1
C.第一次剩余4.8 g金属为铜和铁
D.向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L
查看答案和解析>>
科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:填空题
(9分)钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
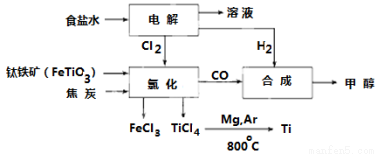
请回答下列问题:
(1)Fe位于元素周期表中第____________周期,第___________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 L 1.0 mol·L-1NaAlO2溶液中含有氧原子数为2NA
B.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
C.1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
D.精炼铜的过程中,当阳极溶解32 g铜时转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转
化关系: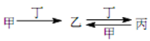 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A、若甲为焦炭,则丁可能是 O2
B、若甲为 SO2,则丁可能是氨水
C、若甲为 Fe,则丁可能是盐酸
D、若甲为 NaOH 溶液,则丁可能是 CO2
查看答案和解析>>
科目:高中化学 来源:2016届广东省揭阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。

已知:室温下,① 2NO+Na2O2=2NaNO2
② 酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,
5 NO2— + 2MnO4—+ 6H+= 5NO3—+ 2Mn2++ 3H2O
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有______________,_______________。
(3)装置C的作用:________________,装置F的作用:_______________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液
C.淀粉 D.白糖
E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 ml,取出25 ml溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:实验题
用 18 mol/L 的浓硫酸配制 100 mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL , 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。 A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的具体操作是_____________________________________
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④加水超过刻度线后, 用胶头滴管吸出多余的液体___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=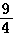 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com