


科目:高中化学 来源: 题型:
| A、配制银氨溶液:质量分数为2% 氨水中加入过量的硝酸银溶液 |
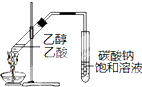
| B、制备乙酸乙酯:用如右图所示的实验装置 |
| C、鉴定溴乙烷中的溴原子:向溴乙烷中加入硝酸酸化的硝酸银溶液 |
| D、鉴别地沟油和矿物油:加入足量氢氧化钠溶液加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、1L0.1mol?L-1氨水含有0.1lNA个OH- |
| D、1mol甲醇中含有C-H键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
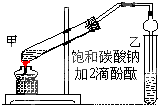 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④ |
| C、①② | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| A、IA | B、ⅢA | C、ⅤA | D、ⅦA |
查看答案和解析>>
科目:高中化学 来源: 题型:
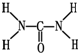 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.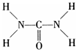 ,则尿素分子中C和N原子的杂化方式分别是
,则尿素分子中C和N原子的杂化方式分别是查看答案和解析>>
科目:高中化学 来源: 题型:
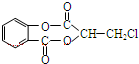 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).
查看答案和解析>>
科目:高中化学 来源: 题型:
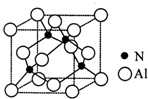 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com