
 如图表示某反应的能量变化,对于该图的理解,你认为一定正确的是( )
如图表示某反应的能量变化,对于该图的理解,你认为一定正确的是( )| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
分析 A、曲线Ⅰ和曲线Ⅱ都是指同一反应物生成同一生成物;
B、曲线Ⅱ反应物能量大于生成物能量,则该反应为放热反应;
C、反应放热与反应条件没有必然的联系;
D、依据反应物和生成物能量变化判断反应吸热、放热.
解答 解:A、曲线Ⅰ和曲线Ⅱ都是指同一反应物生成同一生成物,所以表示一个化学反应的能量变化,故A错误;
B、曲线Ⅱ反应物能量大于生成物能量,则该反应为放热反应,又2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2为吸热反应,所以不可表示反应2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2的能量变化;故B错误;
C、图中分析判断反应是放热反应,△H<0,但反应放热与反应条件没有必然的联系,有许多放热在开始时要加热的,故C错误;
D、依据图象分析判断,该反应为放热反应,△H=E2-E1,故D正确;
故选D.
点评 本题考查了反应焓变的计算判断,图象分析是关键,反应自发进行的判断依据,催化剂的作用分析是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷分子所含质子数为10NA | |
| B. | 1mol乙烷分子含有8NA个共价键 | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
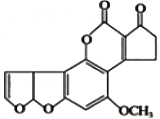 目前,我国有不法商贩用地沟油牟取暴利.医学研究证明,地沟油中的黄曲霉素强烈致癌.已知一种黄曲霉素的结构简式如图所示,关于该分子的说法中正确的是
目前,我国有不法商贩用地沟油牟取暴利.医学研究证明,地沟油中的黄曲霉素强烈致癌.已知一种黄曲霉素的结构简式如图所示,关于该分子的说法中正确的是| A. | 1个分子中共含有30个δ键 | B. | 有5个碳原子采用sp3杂化 | ||
| C. | 属于极性分子,易溶于水 | D. | 分子中所有原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的催化氧化是工业上生产硫酸的关键步骤.
SO2的催化氧化是工业上生产硫酸的关键步骤.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合条件的X元素有2种 | |
| B. | Y的最高价氧化物的水化物不可能是强酸 | |
| C. | Y的氢化物中可能存在离子键 | |
| D. | Y的单质在常温下可能是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com