
二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如图所示,下列说法正确的是( )

|
| A. | 二茂铁中Fe2+与环戊二烯离子(C5H5﹣)之间为离子键 |
|
| B. | 1mol环戊二烯中含有σ键的数目为5NA |
|
| C. | 分子中存在π键 |
|
| D. | Fe2+的电子排布式为1s22s22p63s23p63d44s2 |
考点:
共价键的形成及共价键的主要类型;原子核外电子排布.
专题:
原子组成与结构专题;化学键与晶体结构.
分析:
A.该分子是一种金属有机配合物;
B.环戊二烯中含3个C﹣C和2个C=C、6个C﹣H键;
C.C=C中含π键,
D.Fe的原子序数为26.
解答:
解:A.该分子是一种金属有机配合物,则不存在离子键,故A错误;
B.环戊二烯中含3个C﹣C和2个C=C、6个C﹣H键,则1mol环戊二烯中含有σ键的数目为11NA,故B错误;
C.C=C中含π键,所以分子中存在π键,故C正确;
D.Fe的原子序数为26,亚铁离子的核外有24个电子,所以Fe2+的电子排布式为1s22s22p63s23p63d54s1,半满为稳定结构,故D错误;
故选C.
点评:
本题以信息的形式考查有机配合物的中的化学键,注意环戊二烯的结构及电子排布规律即可解答,选项A为解答的易错点,题目难度较大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物.
(1)常温下用1mol•L﹣1200mLNaOH溶液恰好完全吸收0.1molSO2气体,此反应的离子方程式为 ,请用离子方程式表示该溶液PH>7的原因 H ,该溶液放置于空气中一段时间后,溶液的PH (填“增大”“减小”或“不变”)
(2)SO2能使酸性高锰酸钾溶液褪色,该反应的离子方程式为 ,实验室通常选择 (选填“稀盐酸”、“稀硫酸”)对高锰酸钾溶液进行酸化.
(3)课本中选用Na2S2O3与稀硫酸的反应来研究物质的温度对化学反应速率的影响.选用Na2S2O3来比较化学反应速率快慢的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
|
| A. | 常温下,4.48L N2和O2的混合气体中所含原子数为0.4NA |
|
| B. | 常温下,1.0L1.0mol•L﹣1 NaAlO2溶液中含有的氧原子数为2NA |
|
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
|
| D. | 0.1mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应NaClO+2HCl=NaCl+H2O+Cl2↑,被氧化的氯原子与被还原的氯原子之比是( )
|
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列各组物质 ①O2和O3 ②12C和14C ③CH3CH2CH2CH3和(CH3)2CHCH3
④干冰和SiC ⑤金刚石和SiO2
它们的晶体属于分子晶体的是 ,互为同位素的是 ,属于原子晶体的是 .
(2)配离子[TiCl(H2O)5]2+的中心离子的符号为 ,配位数为 .
(3)写出下列方程式
①甲酸(HCOOH)与甲醇(CH3OH)在浓硫酸加热条件下发生酯化反应的化学方程式
②苯与液溴在溴化铁催化剂下反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是()
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C. 0.1 mol•L﹣1 NaF溶液中,HF和F﹣总和为0.1NA个
D. 12.5 mL 16 mol•L﹣1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
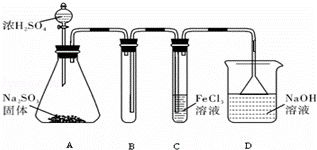
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 ,操作中不需要的仪器有 (填字母).
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C中观察到的现象为 ,
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成取 ;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣.该做法 (填“合理”或“不合理”),理由是 .
(4)D装置中倒置漏斗的作用是 .
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有 (填入正确选项前的字母).
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com