
| A. | 标准状况下,11.2LCHCl3含有共价键数为2NA | |
| B. | 某温度下,纯水pH=6,该温度下1LpH=11的NaOH溶液中含有OH-数目为0.1NA | |
| C. | 含3.65gHCl的水溶液中含有粒子数为0.2NA | |
| D. | 0.2mol/LNa2S溶液中含有S2-数目小于0.2NA |
分析 A、标况下,三氯甲烷为液态;
B、某温度下,纯水pH=6,即水的离子积为10-12;
C、求出3.65gHCl的物质的量,然后根据盐酸溶液中除了含氯离子、氢离子还有水分子;
D、溶液体积不明确.
解答 解:A、标况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和共价键数,故A错误;
B、某温度下,纯水pH=6,即水的离子积为10-12,故pH=11的氢氧化钠溶液中,氢氧根的物质的量浓度为0.1mol/L,则1L溶液中氢氧根的物质的量为0.1mol,个数为0.1NA个,故B正确;
C、3.65gHCl的物质的量为0.1mol,而盐酸溶液中除了含氯离子、氢离子还有水分子、氢氧根,故含有的粒子数大于0.2NA个,故C错误;
D、溶液体积不明确,故溶液中含有的硫离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将浓硫酸入蔗糖中 | 固体变黑后发生膨胀 | 浓硫酸具有吸水性和强还原性 |
| B | 将两小粒相同的钠分别投入乙醇和水中 | 钠在水中反应比在乙醇中剧烈 | 相同条件下,水的电离能力比乙醇强 |
| C | 向某溶液滴加氯水后再滴入KCSN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 常温时将铝片加入浓硝酸中 | 未出现气泡 | 常温下铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水 | B. | CH3COONa固体 | C. | 升温 | D. | NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
(注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.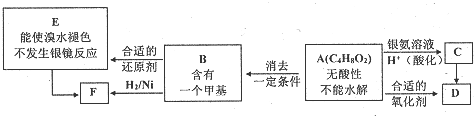
 或
或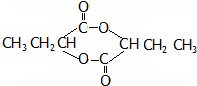 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:3 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com