
| A. | 提出了元素周期律 | B. | 开发了合成氨的生产工艺 | ||
| C. | 揭示了燃烧的本质 | D. | 提取了治疟药物青蒿素 |
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 水电离出的c(OH-)=10-10mol•L-1:Al3+、NH4+、Ca2+、NO3- | |
| C. | c(H+)=10-14 mol•L-1 的溶液中:Na+、AlO2-、S2-、SO32- | |
| D. | pH试纸变红的溶液中:Fe3+、I-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
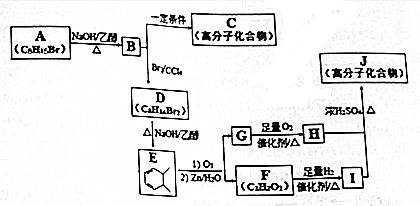
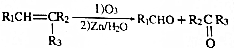
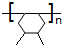 .
.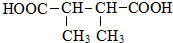 +n HOCH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2OH$→_{△}^{浓硫酸}$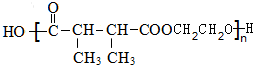 +(2n-1)H2O.
+(2n-1)H2O.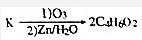 ,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式
,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:d>b | |
| B. | 最高价氧化物对应水化物的酸性:d>c | |
| C. | 化合物ac2中含有离子键 | |
| D. | 氧元素分别与a、b形成的化合物都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族的元素全部是金属元素 | |
| B. | 元素周期表有18个纵行,即18个族 | |
| C. | 短周期是第一、二、三、四周期 | |
| D. | 元素周期表有七个横行,也是七个周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+Br2→CH2Br-CH2Br | B. | CH3CH2CHO+HCN→CH3CH2CH(CN)OH | ||
| C. | CH3CH2OH→CH2=CH2↑+H2O | D. | CH3CH2OH+HBr→CH3CH2Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为 .
.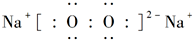 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com