
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:Na+、AlO${\;}_{2}^{-}$、S2-、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Fe3+的溶液中:Na+、SCN-、K+、NO${\;}_{3}^{-}$ | |
| D. | c(H+)=10-14 mol•L-1的溶液中:Mg2+、NO${\;}_{3}^{-}$、Fe2+、ClO- |
分析 A.pH=1的溶液呈酸性;
B.由水电离出的c(OH-)=1×10-13 mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
C.与Fe3+反应的离子不能大量共存;
D.c(H+)=10-14 mol•L-1的溶液呈碱性.
解答 解:A.pH=1的溶液呈酸性,酸性条件下Fe2+、NO3-发生氧化还原反应,故A错误;
B.由水电离出的c(OH-)=1×10-13 mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故B正确;
C.SCN-与Fe3+反应而不能大量共存,故C错误;
D.c(H+)=10-14 mol•L-1的溶液呈碱性,碱性条件下,Mg2+、Fe2+不能大量共存,故D错误.
故选B.
点评 本题考查离子共存问题,题目难度不大,本题侧重于不同条件下的离子之间的反应的考查,答题时注意审题,把握离子的性质为解答该类题目的关键.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 离子 | 检验方法 |
| A | CO32- | 向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观察溶液是否变浑浊 |
| B | SO42- | 向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成 |
| C | Fe2+ | 取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去 |
| D | I- | 取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼粗铜时,粗铜作阳极 | |
| B. | 在原电池中,铜电极只能作正极 | |
| C. | 在镀件上镀铜时,金属铜作阳极 | |
| D. | 锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和稀盐酸 | B. | Al2O3和NaOH溶液 | ||
| C. | NH4HCO3和NaOH溶液 | D. | CO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
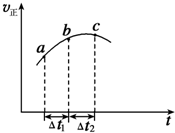 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
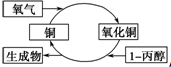
| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Na+、ClO-、SO42-、Fe2+ | ||
| C. | Ba2+、K+、HCO3-、NO3- | D. | Ba2+、Na+、SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以使纯水中的c(H+)>c(OH-) | |
| B. | 在NaOH溶液中没有H+,在HCl溶液中没有OH- | |
| C. | 水的电离过程是一个吸热过程 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com