
分析 平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,写出每个反应的化学平衡常数表达式.
解答 解:平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,
反应(1)H2(g)+$\frac{1}{2}$S2(g)?H2S(g)平衡常数K(1)=$\frac{c({H}_{2}S)}{c(H{\;}_{2}){c}^{\frac{1}{2}}(S{\;}_{2})}$,
反应(2)3H2(g)+SO2(g)?2H2O(g)+H2S(g)平衡常数K(2)=$\frac{c(H{\;}_{2}S){c}^{2}(H{\;}_{2}O)}{{c}^{3}(H{\;}_{2}){c}^{2}(S{O}_{2)}}$,
反应(3)4H2(g)+2SO2(g)?S2(g)+4H2O(g) 平衡常数K=$\frac{c(S{\;}_{2}){c}^{4}(H{\;}_{2}O)}{{c}^{4}(H{\;}_{2}){c}^{2}(SO{\;}_{2})}$,
反应2×(2)-2×(1)=反应(3),所以K=$\frac{{{K}^{2}}_{(2)}}{{{K}^{2}}_{(1)}}$=$\frac{(1.8×10{\;}^{4})^{2}}{0.80{\;}^{2}}$=5.06×108,
答:反应4H2(g)+2SO2(g)?S2(g)+4H2O(g)在该温度时的平衡常数KΘ 为5.06×108.
点评 本题考查化学平衡常数的意义,和平衡常数的书写、及综合应用,难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
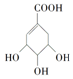 ,关于它的叙述中不正确的是( )
,关于它的叙述中不正确的是( )| A. | 该有机物能使溴的四氯化碳溶液褪色 | |
| B. | 该有机物发生消去反应可得到芳香烃 | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 1 mol该有机物最多可与1 mol NaHCO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
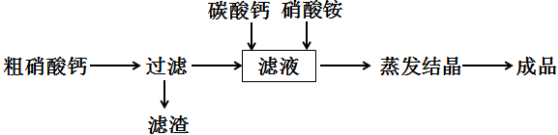

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
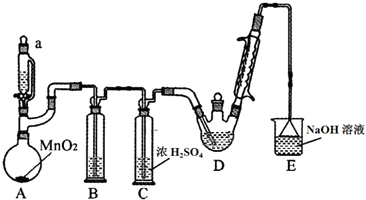
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+534 kJ•L-1 | |
| B. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-53.4 kJ•L-1 | |
| C. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+53.4 kJ•L-1 | |
| D. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-534 kJ•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com