
科目:高中化学 来源:不详 题型:单选题
| A.PH3分子中有未成键的孤对电子 | B.PH3是非极性分子 |
| C.它的分子构型是平面三角形 | D.磷原子采用sp2杂化方式 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
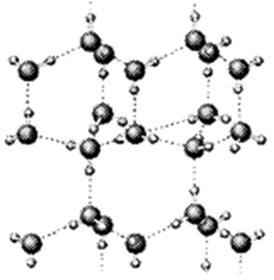
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104s1, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“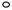 ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4、CS2、BF3 | B.CO2、H2O、NH3 |
| C.C2H4、C2H2、C6H6 | D.CCl4、BeCl2、PH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧元素的一种同位素 | B.臭氧的同素异形体 |
| C.一种新的氧化物 | D.一种新的化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N放出942 kJ热量,根据以上信息和数据,下列说法正确的是( )
N放出942 kJ热量,根据以上信息和数据,下列说法正确的是( )
| A.N4属于一种新型的化合物 |
| B.N4与N2互称为同位素 |
| C.N4化学性质比N2稳定 |
| D.1 mol N4气体转变为N2将放出882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
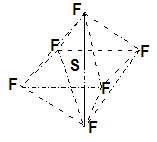
| A.SF6易燃烧生成SO2 |
| B.SF6是极性分子 |
| C.SF6中各原子均达到八电子稳定结构 |
| D.高温条件下,SF6微弱水解生成H2SO4和HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com