
分析 (1)依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积,据此选择容量瓶规格;量取时发现量筒不干净用水洗净后直接量取实质将溶液稀释,据此解答;
(2)氯化铁水解生成氢氧化铁胶体,溶液出现透明的红褐色;
(3)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,二者物质的量之比为2:1,据此书写方程式,依据方程式判断反应后溶液溶质成分.
解答 解:(1)解:设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变计算得:18.4mol/L×V=
0.5mol/L×500mL,解得V=13.6mL,应选择15mL量筒;量取时发现量筒不干净用水洗净后直接量取实质将溶液稀释,所以溶液浓度偏低;
故答案为:15;偏低;
(2)氯化铁水解生成氢氧化铁胶体,水方程式为:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl,溶液出现透明的红褐色;
故答案为:红褐色; FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;
(3)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,二者物质的量之比为2:1,化学方程式:2NaHSO4+2Ba(OH)2=BaSO4↓+2H2O,反应离子方程式:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;反应后溶质为:硫酸钠,化学式为:Na2SO4;
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O; Na2SO4.
点评 本题考查了一定物质的量浓度溶液的配制和离子方程式书写,明确溶液稀释规律及量筒规格选择依据,熟悉氢氧化铁胶体制备过程是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的分解速率是Y的消耗速率的2倍 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内生成l mol Y的同时分解2 mol X | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
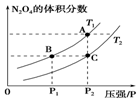 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.945795506 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X弱于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com