
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论????????? ???????????????? ? 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 ??? (填字母序号)。
? A.溶液温度下降? B.溶液温度升高??? C.滴入酚酞后呈浅红色? ????? D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象???????????????????? 。
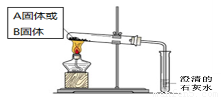
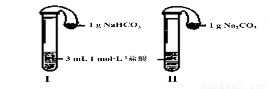
(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体,????????? (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是????????? 。
A.装置I的气球体积较大???????????? B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算?????? D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
实验方案 | 预测现象 | 预测依据 | 实际结果 |
实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1:???????????????? ????? ???????????? ;实验2:???????????????????? ?????? ?????? 。
(1)①同温度下,Na2CO3比NaHCO3易溶于水(2分,不说明温度条件的扣1分)
②B、D(2分)
(2)Ca(OH)2+CO2=CaCO3↓+H2O(2分)????? CaCO3+CO2+H2O=Ca(HCO3)2(2分)
(3)①Ⅰ(2分)??? (2)A、C(2分,少选1个得1分,错选、不选不得分)
(4)实验1:Ca2++CO32-=CaCO3↓(2分)?? ?? 实验2:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O(2分)
【解析】
试题分析: (1)本题探究的Na2CO3和NaHCO3两种物质都是我们中学阶段非常熟知的两种钠盐,这两种物质进行对比,很多性质可以直接结合我们所学内容得出。此处称取等量的两种物质溶解,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在相同温度下Na2CO3固体的溶解度要大于NaHCO3固体。这两种钠盐溶解均是放热的,所以会使体系温度升高。同时它们均是强碱弱酸盐,水解呈碱性使酚酞变红。故选BD。
(2)NaHCO3 受热易分解产生CO2,使澄清石灰水变浑浊,但是通了一段时间的CO2后,产生的沉淀CaCO3又与过量的CO2反应生成了可溶的Ca(HCO3)2,所以溶液又变澄清。整个过程发生的反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O? 、 CaCO3+CO2+H2O=Ca(HCO3)2? 。
(3)①②Na2CO3和NaHCO3两种物质均能与HCl反应产生CO2气体,但是反应中CO32- 要先与H+反应生成HCO3-,然后再由HCO3-与H+反应生成CO2,经过2个步骤,所以装置I反应要慢,装置II要跟更为剧烈。
②所得气球的体积大小主要看反应生成的CO2气体的体积,根据C原子守恒,1g的Na2CO3和1g NaHCO3 中,NaHCO3 能生成的CO2物质的量大,所以产生的气体多,故A正确;此实验中盐酸均完全反应,所以气体体积根据盐酸来计算,故C正确;故选AC。
(4)实验1中产生白色沉淀是由于钙离子和碳酸根离子结合生成了碳酸钙沉淀,所以离子方程式为:
Ca2++CO32-=CaCO3↓;而实验2中理论上HCO3-与Ca2+ 不能反应,没有沉淀生成,但是由实际结果推测HCO3-发生微弱电离产生CO32-和H+,电离产生的CO32-与Ca2+ 结合生成了碳酸钙沉淀,同时进一步促进了电离,使得电离产生的H+又与溶液中的HCO3-反应生成CO2气体,所以离子方程式为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O。
考点:本题考查的是以中学阶段常见的两种钠盐为实验对象的基础探究实验。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:阅读理解
 (2009?广东模拟)某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
(2009?广东模拟)某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。
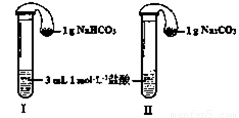
①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。
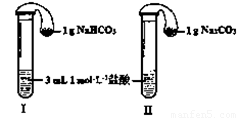
①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。
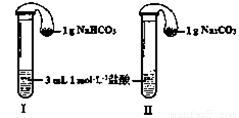
①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com