
【题目】实验室需配制0.2000molL﹣1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是_________(填字母),还缺少的玻璃仪器是_________(填仪器名称)。
(2)根据计算需用天平称取Na2S2O3固体的质量是_________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________(填“>”“<”或“=”,下同)0.2000molL﹣1.若还未等溶液冷却就定容了,则所得溶液浓度_________0.2000molL﹣1。
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000molL﹣1Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为_________。
②NaClO溶液的物质的量浓度是_________。
【答案】AB 烧杯、玻璃棒 15.8 = > ClO﹣+2I﹣+2H+═Cl﹣+I2+H2O 0.1100 mol/L
【解析】
(1)用Na2S2O3固体来配制标准溶液,不需要圆底烧瓶、分液漏斗;溶解Na2S2O3固体,还需要烧杯、玻璃棒;
故答案为AB;烧杯、玻璃棒;
(2)配制0.2000molL﹣1Na2S2O3标准溶液450mL,实验室没有450mL的容量瓶,应选用500mL的容量瓶,需要Na2S2O3固体,n=0.2000mol/L×0.5L=1.000mol,m=1.000mol×158g/mol=15.8g;
定容时,还需要向容量瓶中加入蒸馏水,若容量瓶用蒸馏水洗涤后未干燥,不会产生误差;未等溶液冷却就定容了,冷却后,溶液体积减小,所得溶液浓度偏大;
故答案为15.8;=;>;
(3)①NaClO溶液中加入适量稀盐酸和足量KI固体时发生氧化还原反应,其离子方程式为ClO﹣+2I﹣+2H+═Cl﹣+I2+H2O;
②第二次数据明显偏小,不能采用,其余3次平行实验测定的平均体积为:V(Na2S2O3)=![]() =22.00mL,
=22.00mL,
设NaClO溶液的浓度是x,根据反应ClO﹣+2I﹣+2H+═Cl﹣+I2+H2O、I2+2Na2S2O3═2NaI+Na2S4O6
可得关系式:NaClO~2Na2S4O6
1 2
20mL×c 0.2000mol/L×22.00mL
解得:c=0.1100mol/L,
故答案为ClO﹣+2I﹣+2H+═Cl﹣+I2+H2O;0.1100mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】写出下列热化学反应方程式:
(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:______________。
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量:_______________。
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH= -92.3kJ/mol
Cl2(g)的ΔH= -92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
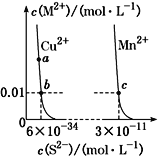
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种飞船以![]() 和
和![]() 为动力源,发生反应:
为动力源,发生反应:![]() ,反应温度可高达2700℃,若有
,反应温度可高达2700℃,若有![]() 被氧化,则下列判断不正确的是( )
被氧化,则下列判断不正确的是( )
A.生成![]() (标准状况下)
(标准状况下)
B.被还原的氮原子的物质的量为![]()
C.转移电子的物质的量为![]()
D.氧化产物比还原产物多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )

A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号: B__________,C __________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)E元素的正三价离子的电子排布式为____________________________________。
(5)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式____________________。
(6)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
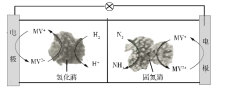
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是 ( )
H++OH- △H>0,下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com