
| A. | 再通入$\frac{W}{10}$g氯化氢 | B. | B、蒸发浓缩成$\frac{W}{2}$g | ||
| C. | 蒸发掉溶剂的一半 | D. | 再加入2Wg25%盐酸 |
分析 根据物质的量浓度C=$\frac{n}{V}$可知,若将Wg10%的盐酸的浓度增大一倍,则需在溶液体积不变的前提下将溶质的物质的量增加一倍,或在溶质的物质的量不变的前提下,将溶液体积缩小为原来一半,据此分析.
解答 解:A、Wg10%的盐酸中含有的额HCl的质量为$\frac{W}{10}g$,若再通入$\frac{W}{10}$g氯化氢,则溶质的物质的量变为原来的2倍,而溶液体积不变,故物质的量浓度增大一倍,故A正确;
B、盐酸易挥发,故将盐酸蒸发浓缩时溶质HCl会挥发,故将盐酸蒸发浓缩成$\frac{W}{2}$g时,溶质的质量剩余多少无法计算,则B错误;
C、盐酸易挥发,故将盐酸蒸发浓缩时溶质HCl会挥发,故将溶液蒸发掉溶剂的一半时,溶质的质量也会损失,且当蒸发掉溶剂的一半时,溶液的体积并不是原来的一半,则C错误;
D、向Wg10%的盐酸中再加入2Wg25%盐酸的盐酸,则溶质的质量m=0.1Wg+0.5Wg=0.6Wg,溶液质量变为3Wg,故溶质的质量分数变为$\frac{0.6Wg}{3Wg}×100%$=20%,变为原来的2倍,但溶液的密度也会随着溶液浓度的改变而改变,故根据物质的量浓度C=$\frac{1000ρω%}{M}$可知,物质的量并不是变为原来的2倍,故D错误.
故选A.
点评 本题考查了使溶液的浓度改变的方法,应注意的是在蒸发浓缩时,HCl会挥发,故不能用此法来增大HCl的浓度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
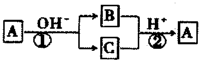
| A. | 反应①和②是可逆反应 | B. | 反应①和②一定为氧化还原反应 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | X元素为铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中少量的CO | 点燃 |
| B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3v(N2) | C. | v(NH3)=1.5v(H2) | D. | v(N2)=2v(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的质软金属,密度都很小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 碱金属单质与水剧烈反应生成碱和H2 | |
| D. | 单质熔沸点随着原子序数的增加而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6 | B. | C3H4 | C. | C4H6 | D. | C5 H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与活泼金属反应生成氢气 | |
| C. | 10mL1mol/L的甲酸恰好与10mL1mol/L的NaOH溶液完全反应 | |
| D. | 在相同浓度下,甲酸的导电性比二元强酸溶液的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com