
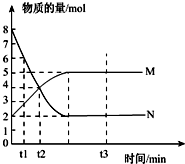
 (1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:分析 (1)①反应达到平衡状态时,△n(M)=(5-2)mol=3mol,△n(N)=(8-2)mol=6mol,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比;
②当可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、质量、物质的量浓度、百分含量以及由此引起的物理量不变;
(2)v(SO3)=$\frac{0.6-0}{2}$mol/(L.s)=0.3mol/(L.s),再根据同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比计算氧气反应速率;参加反应的n(SO3)=0.6mol/L×2s=1.2mol,则参加反应的n(SO2)=n(SO3)=1.2mol,二氧化硫的转化率=$\frac{参加反应的二氧化硫的物质的量}{二氧化硫的总物质的量}$×100%.
解答 解:(1)①反应达到平衡状态时,△n(M)=(5-2)mol=3mol,△n(N)=(8-2)mol=6mol,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,所以a:b=6mol:amol=2:1,
故答案为:2:1;
②A.反应中M与N的物质的量之比为1:1时,该反应不一定达到平衡状态,与反应初始物质的量及转化率有关,故错误;
B.混合气体的总质量不随时间的变化而变化,遵循质量守恒定律定律,反应前后气体总质量始终不变,所以不能判断是否达到平衡,故错误;
C.混合气体的平均摩尔质量不随时间的变化而变化,该反应正逆反应速率相对,反应达到平衡状态,故正确;
D.单位时间内每消耗a mol N,同时生成b mol M,无论是否达到平衡状态都存在这种变化,所以不能判断平衡状态,故错误;
E.反应前后气体体积减小,所以反应前后气体压强降低,当混合气体的压强不随时间的变化而变化,该反应达到平衡状态,故正确;
故选CE;
(2)v(SO3)=$\frac{0.6-0}{2}$mol/(L.s)=0.3mol/(L.s),再根据同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比计算氧气反应速率=0.15mol/(L.s);参加反应的n(SO3)=0.6mol/L×2s=1.2mol,则参加反应的n(SO2)=n(SO3)=1.2mol,则2s末O2浓度=$\frac{4-1.2}{2}$mol/L=1.4mol/L,二氧化硫的转化率=$\frac{参加反应的二氧化硫的物质的量}{二氧化硫的总物质的量}$×100%=$\frac{1.2mol}{4mol}$×100%=30%,
故答案为:0.15 mol/(L.s); 1.4mol/L; 30%.
点评 本题考查化学平衡有关计算及平衡状态判断,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式、化学平衡状态判断依据是解本题关键,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,为易错点.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ①=②>③>④ | D. | ①=②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
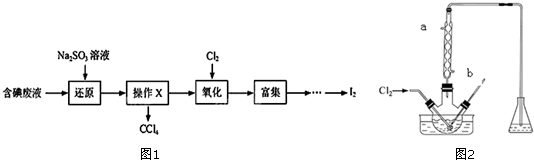
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 饮用的白酒是纯净物,即乙醇 | |
| C. | 酿酒过程中发生了物理变化和化学变化 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
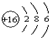 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com