
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
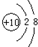
分析 a是单核且含有10电子的微粒,则a是Ne;
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,
根据以上分析结合元素周期律知识进行解答.
解答 解:a是单核且含有10电子的微粒,则a是Ne;b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;c是双核10电子微粒,且带一个单位负电荷,则c是OH-;d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;e是单核带2个单位正电荷的10电子阳离子,则e是Mg2+;f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为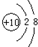 ,故答案为:
,故答案为: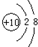 ;
;
(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)D为氨气,氨水是若电解质存在电离平衡,电离生成铵根离子和氢氧根离子,电离方程式为NH3•H2O?NH4++OH-;
故答案为:NH3•H2O?NH4++OH-;
(4)c的化学式为:OH-,f是H3O+,故答案为:OH-;H3O+;
(5)b为钠离子,其对应单质为钠,g为水,钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,注意掌握原子结构与元素周期律、元素周期表的关系,注意掌握常见化学用语的概念及表示方法.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 提倡绿色生活,使用公共交通 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 研制出性能优良的催化剂,降低反应所需温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
实验室中一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2S、Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )| A. | 只用盐酸一种试剂就可以确定该固体M的成分 | |
| B. | 往溶液中加入稀硝酸酸化的BaCl2溶液,若有白色沉淀生成,则固体M为Na2SO4 | |
| C. | 往溶液中通入二氧化碳,若有白色沉淀生成,则固体M为Na2SiO3 | |
| D. | 只用氯水一种试剂就可以确定该固体M的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
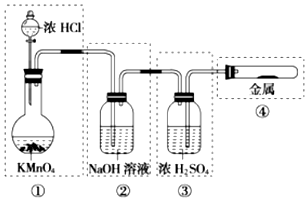
| A. | ①和②处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com