
| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4Cl三种溶液可以用加入NaOH溶液并加热的方法区分开 | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 用湿润的KI淀粉试纸可以检验溴蒸气中是否含有NO2 |
分析 A.加入浓盐酸(必要时可加热),反应现象不同;
B.(NH4)2SO4、NH4Cl加入NaOH溶液加热现象相同;
C.硝酸钾的溶解度随温度变化较大,可用重结晶的方法分离;
D.溴和NO2均可氧化碘离子.
解答 解:A.加入浓盐酸,加热条件下,二氧化锰和浓盐酸反应生成黄绿色气体,氧化铜和盐酸反应,溶液变成蓝色,铁和盐酸反应生成气体,现象不同,可鉴别,故A错误;
B.(NH4)2SO4、NH4Cl加入NaOH溶液加热都有氨气生成,无法区别,故B错误;
C.硝酸钾的溶解度随温度变化较大,除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤,析出硝酸钾,氯化钠残留在溶液中,故C正确;
D.溴和NO2均可氧化碘离子,则湿润的KI淀粉试纸不能检验溴蒸气中是否含有NO2,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及物质的检验、鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
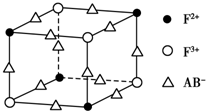 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 200 | 300 | 400 |
| 气体体积/Ml | 224 | 280 | 280 |
| 剩余固体/mg | 14 | 67.5 | 167.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 等体积、等浓度的稀溶液Ba(OH)2与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器底部没有固体,则溶液中只有Cu2+ | |
| B. | 若容器底部固体既有铜又有铁,则溶液中只有Fe2+ | |
| C. | 若容器底部固体为铜,则溶液中可能有Cu2+和Fe3+ | |
| D. | 若容器底部无固体,再加入铁粉,溶液中阳离子的种类不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,
取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与溴水常温可以反应,而苯与溴水不能反应 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com