
【题目】如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题:

(1)若X、Y是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,在X极附近观察到的现象是______________________________;Y电极上的电极反应式是 ___________________,电解NaCl溶液的离子方程式是________________________________。
(2)若要在铜制品上镀Ag,则电解质溶液a可为___________________,Y电极反应式为_________________________________。
(3)若上图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式_________________,电池工作过程中,正极附近的pH将______(填“增大、减小或不变”)。
【答案】石蕊溶液变蓝,有气泡产生 2Cl--2e-=Cl2↑ 2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑ AgNO3溶液 Ag-e-=Ag+ CH3OH-6e-+8OH- = CO32-+6H2O 增大
2OH-+Cl2↑+H2↑ AgNO3溶液 Ag-e-=Ag+ CH3OH-6e-+8OH- = CO32-+6H2O 增大
【解析】
(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子;
(2)若要在铜上镀银,镀层作阳极,镀件作阴极,电解质为含有与阳极材料相同金属元素的可溶性盐,阴极上银离子得电子发生还原反应;
(3)依据燃料电池中燃料在负极失电子发生氧化反应,结合电荷守恒配平书写电极反应。
(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴石蕊试液会变蓝,则在X极附近观察到的现象是石蕊溶液变蓝,有气泡产生;
和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e- =Cl2↑,电解NaCl溶液的离子方程式是2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(2)若要在铜上镀银,镀层作阳极,镀件作阴极,要想在铜上镀银,电解质为含有与阳极材料相同金属元素的可溶性盐,则电解质溶液a可为AgNO3溶液;Y电极为阳极,Ag失电子产生Ag+,电极反应式为Ag- e- = Ag+;
(3)若上图装置中的电源为甲醇-空气-KOH溶液的燃料电池,甲醇在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,则电池负极的电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,电池工作过程中,正极氧气得电子产生OH-,附近的pH将增大。


科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的密闭容器中![]() 体积不变
体积不变![]() 充入
充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。下列说法正确的是
的浓度随时间变化如图所示。下列说法正确的是
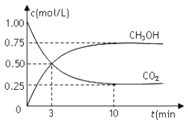
A.从反应开始到平衡,氢气的平均反应速率为![]()
B.进行到3min时,正反应速率和逆反应速率相等
C.10min后容器中各物质的量浓度不再改变
D.到达平衡状态时,反应放出![]() 的能量
的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
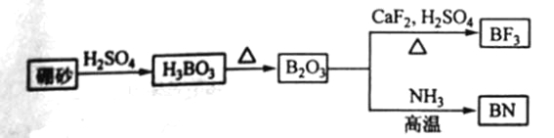
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是
A.Mg片作负极,电极反应:Mg-2e- ![]() Mg2+
Mg2+
B.Al片作负极,电极反应:Al+4OH- -3e- ![]() AlO2- +2H2 O
AlO2- +2H2 O
C.电子从Mg电极沿导线流向Al电极
D.Al片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为 :下列说法正确的是( )
:下列说法正确的是( )
A.M的分子式为![]() B.淀粉与纤维素互为同分异构体
B.淀粉与纤维素互为同分异构体
C.![]() 的反应类型属于取代反应D.N的结构简式为
的反应类型属于取代反应D.N的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2N2O5(g )=2N2O4( g )+O2( g ) H1=-4.4kJ·mol-1
2NO2( g)=N2O4(g ) H2 =-55.3kJ·mol-1
则反应N2O5( g )=2NO2(g )+![]() O2(g )的H=_______ kJ·mol-1
O2(g )的H=_______ kJ·mol-1
(2)2molCH3OH(l)在O2(g)中完全燃烧,生成CO2(g)和H2O(l),放出887kJ热量:请写出CH3OH燃烧热的热化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图______________。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子间的距离为____________________________________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com