
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
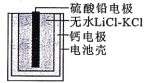
A. Ca为正极 B. 放电过程中,Li+向负极移动
C. 每转移0.2mol电子,理论上生成20.7gPb D. 电池工作一段时间后,正极质量增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有下列4种重要的有机物:
①![]() ②
②![]() ③
③![]() ④
④![]()
请回答:
(1)能发生银镜反应的是______(填序号)。
(2)能与浓硝酸在一定条件下生成烈性炸药TNT的是______(填序号)。
(3)能与③在一定条件下反应并相互缩合成高分子化合物的是______(填序号)。
(4)写出④在一定条件下发生消去反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钢铁冶炼的说法错误的是( )
①焦炭在炼铁中的作用是产生还原剂和热量
②炼钢中用纯氧代替空气做氧化剂,是为了防止产生污染
③炼铁高炉有两个进口、三个出口
④用含硫较多的生铁炼钢,应加入较多的生石灰
⑤炼铁、炼钢过程中都发生CaO+SiO2![]() CaSiO3
CaSiO3
⑥尽管铁的熔点是1 535 ℃,但高炉中的铁在1 200 ℃左右就呈液态
⑦生铁炼钢的主要目的调节硅锰等的含量、除去硫磷
A. ①⑥ B. ②⑦ C. ③⑤ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如下图所示。下列说法正确的是

A. 石灰乳与Cl2的反应中,Cl2既是氧化剂又是还原剂
B. 25℃时,NaHCO3 在水中的溶解度比Na2CO3 大
C. Cl2与过量的铁反应生成FeCl2
D. 图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的构型判断错误的是( )
A. 甲烷是正四面体结构,烷烃的碳原子呈直线形
B. 乙烯是平面结构,1-丙烯三个碳原子共面
C. 苯分子中碳原子采用sp2杂化,得到平面正六边形结构
D. COCl2为平面结构分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
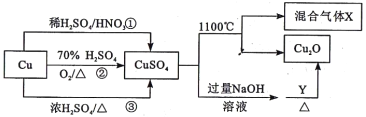
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③
C. 硫酸铜在1100℃分解的方程式为:2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑
Cu2O+SO2↑+SO3↑+O2↑
D. 当Y为葡萄糖时,葡萄糖发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称).
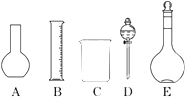
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的________(填写序号).
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算,配制0.2mol/L NaOH溶液500mL需 NaOH固体的质量为:________g.
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:________.
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏小(填写字母)_______ .
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com