
分析 (1)①根据电子层数=周期数,最外层电子数=族序数来回答;同主族,氰化物的稳定性从上到下逐渐减弱;
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷来书写方程式;
(2)①根据弱酸强碱盐水解导致溶液显示碱性来回答;
②根据信息:CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3来书写方程式;
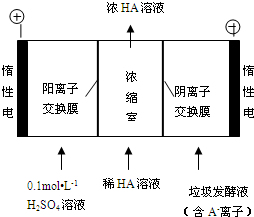
(3)①根据电解池的工作原理:阳极上是阴离子氢氧根离子发生失电子的氧化反应来判断;
②根据电解池的工作原理:在电解池的阳极上是OH-放电,并且H+从阳极通过阳离子交换膜进入浓缩室;
③根据电极反应式结合原子守恒来计算即可.
解答 解:(1)①As电子层数=周期数=4,最外层电子数=族序数=5,所以As位于第四周期,第ⅤA族,同主族,氢化物的稳定性从上到下逐渐减弱,所以AsH3的稳定性比NH3的稳定性弱,故答案为:第四周期,第ⅤA族;弱;
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷,据此得到反应的离子方程式为:2H3AsO3+3S2-+6H+=As2S3+6H2O,
故答案为:2H3AsO3+3S2-+6H+=As2S3+6H2O;
(2)①已知HCN为一元弱酸,则NaCN溶液是强碱弱酸盐,溶液的pH大于7,故答案为:>;
②在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3的方程式为:4H2O+2CN-+O2=2HCO3-+2NH3,故答案为:4H2O+2CN-+O2=2HCO3-+2NH3;
(3)①阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大,
故答案为:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大;
③在阳极上发生电极反应:4OH--4e-═2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA~H+~$\frac{1}{2}$H2,根据差值法,乳酸的浓度变化量是$\frac{145g/L-10g/L}{90g/mol}$=1.5mol/L,即生成HA的物质的量是1.5mol/L×0.4L=0.6mol,所以产生氢气是0.3mol即0.3mol×22.4L/mol=6.72L,故答案为:6.72.
点评 本题涉及元素在周期表中的分布、电解池和原电池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI 的热稳定性依次减弱 | |
| B. | HF、HCl、HBr、HI 的熔沸点逐渐升高 | |
| C. | 第ⅠA族元素和第ⅦA元素形成的化合物都属于离子化合物 | |
| D. | 因为H2O分子间存在氢键,所以热稳定性:H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
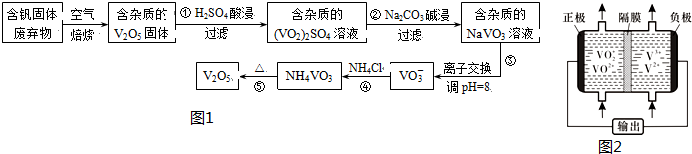
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者消耗NaOH的物质的量相同 | |
| B. | 中和HCl消耗NaOH的物质的量多 | |
| C. | 中和CH3COOH消耗NaOH的物质的量多 | |
| D. | 两者消耗NaOH的物质的量无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com