
| A. |  光伏发电 | B. |  风力发电 | C. |  光合作用 | D. | 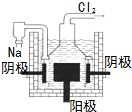 电解制钠 |
科目:高中化学 来源: 题型:选择题
| 待测液 | 消耗标准盐酸(0.1000mol/L)的体积 | |
| ① | 20.00mL NaOH溶液 | V1 mL |
| ② | 20.00mL NaOH溶液+10.00mL水 | V2 mL |
| ③ | 敞口隔夜放置的20.00mL NaOH溶液 | V3 mL |
| A. | c=0.1000×$\frac{{V}_{1}+{V}_{2}+{V}_{3}}{3×20.00}$ | B. | c=0.1000×$\frac{{V}_{1}+{V}_{2}}{2×20.00}$ | ||
| C. | c=0.1000×$\frac{{V}_{1}+{V}_{3}}{2×20.00}$ | D. | c=$\frac{0.1000{V}_{1}}{20.00}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
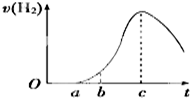 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
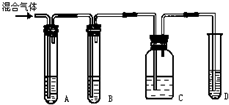
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中,NH4+、Fe3+、SO42-、Cl- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、SO42- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
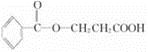 或
或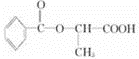 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它是芳香烃 | |
| B. | 1mol该物质,最多可以与1mol H2发生加成反应 | |
| C. | 与1mol该物质反应,消耗Na、NaOH、NaHCO3 的物质的量之比为2:1:1 | |
| D. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com