
科目:高中化学 来源: 题型:实验题
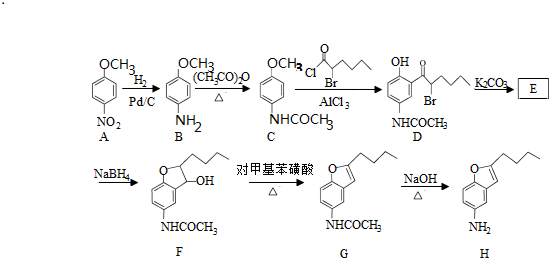
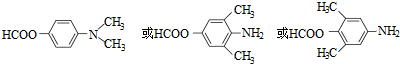 .
.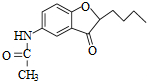 .
. )易被氧化
)易被氧化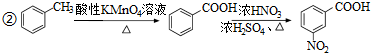
 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | 仅有一句 | B. | 两句 | C. | 三句 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
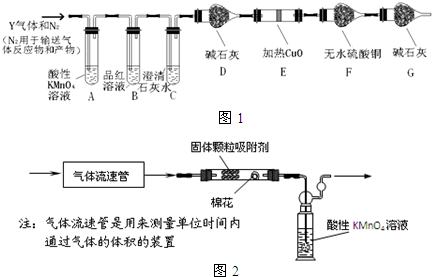
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③④⑥ | C. | 只有①②③ | D. | 只有②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的AOH溶液和H2B溶液,电离程度前者大于后者 | |
| B. | HB-的电离程度大于HB-的水解程度 | |
| C. | 该盐的电离方程式为AHB═A++H++B2- | |
| D. | 在溶液中离子浓度大小顺序一般为.c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com