
分析 (1)三价铁离子水解产生氢氧化铁胶体,胶体表面积大,吸附能力强,达到净水目的;
(2)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀时,溶液中存在两个溶解平衡:Co(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),则可计算出此时溶液中剩下的镍离子浓度,最终得出溶液中$\frac{c(C{o}^{2+})}{c(N{i}^{2+})}$的值;
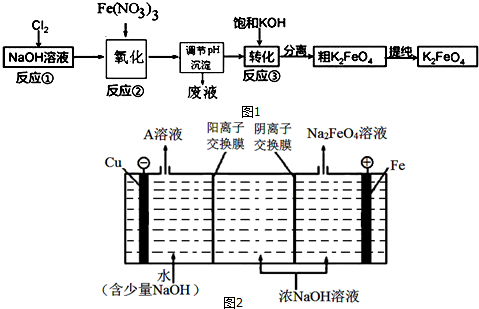
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,据此写出氧化过程的离子方程式;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③Cl2生成ClO-、ClO3-化合价升高,是被氧化的过程,而Cl2生成NaCl是化合价降低被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据ClO-与ClO3-的物质的量浓度之比可计算出失去电子的总物质的量,进而可计算得到电子的总物质的量;再根据氯元素被还原生成KCl的化合价变化为1计算出被还原的氯元素的物质的量,最后计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(4)依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,
则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,
当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,
根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),c(OH-)=$\sqrt{\frac{{K}_{SP}[Co(OH)_{2}]}{c(C{o}^{2+})}}$=$\sqrt{\frac{6.0×1{0}^{-15}}{0.6}}$=10-7mol/L,
则溶液中剩下的镍离子浓度c(Ni2+)=$\frac{{K}_{SP}[Ni(OH)_{2}]}{{c}^{2}(O{H}^{-})}$=$\frac{2.0×1{0}^{-15}}{(1{0}^{-7})^{2}}$=0.2mol/L,溶液中$\frac{c(C{o}^{2+})}{c(N{i}^{2+})}$=$\frac{0.6mol/L}{0.2mol/L}$=3,
故答案为:3;
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO-和ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则被还原的Cl的物质的量为:$\frac{11mol}{1-0}$=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故答案为:11:3;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;NaOH溶液.
点评 本题考查了三价铁离子与Na2FeO4的净水原理,涉及难溶电解质的计算、氧化还原反应方程的书写、计算、电极反应的书写,综合性强,有一定难度,Na2FeO4的净水是常考点,应注意归纳总结.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:实验题
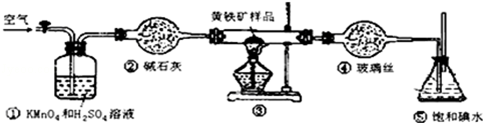
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3. ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
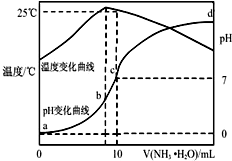 在某温度时,将nmol•L-1氨水滴入10mL1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1氨水滴入10mL1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a点Kw=1.0×10-14 | |
| B. | 25℃时NH4Cl水解常数为:(n-1)×10-7mol•L-1(用n表示) | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 水的电离程度:b>c>a>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各元素在元素周期表中的族序数:W=X>Y>Z | |
| B. | 最高价氧化物对应的水化物的酸性:W>Z | |
| C. | 离子半径:X>Y>Z | |
| D. | YW3不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
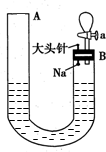 如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:
如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
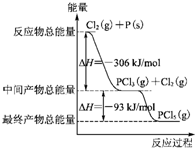 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
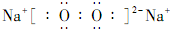 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
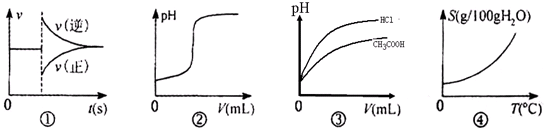
| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH的变化 | |
| C. | 图③可以表示相同pH的醋酸和盐酸溶液分别加水稀释时溶液的pH随体积的变化 | |
| D. | 图④可以表示所有的固体物质溶解度随温度的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com