
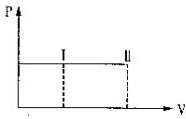
 一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.
一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.| A. | 是放热反应 | |
| B. | 反应后气体总分子数增多 | |
| C. | 是吸热反应 | |
| D. | 反应物具有的总能量等于生成物具有的总能量 |
分析 绝热密闭容器中盛有A、B组成的混合气体,反应:A(g)+B(g)?2C(g)是气体体积不变的反应,由图象可知,体积增大压强不变,说明温度升高,所以该反应为放热反应,据此分析.
解答 解:A、由于该反应是气体体积不变的反应,且容器恒压,而由图可知反应后体积增大,其原因只可能是反应放热,故A正确;
B、根据方程式可知,此反应是气体的分子数不变的反应,故B错误;
C、由于该反应是气体体积不变的反应,而由图可知反应后体积增大,其原因只可能是反应放热,故C错误;
D、由于反应是放热反应,故反应物的总能量大于生成物的总能量,故D错误.
故选A.
点评 本题考查了化学平衡的影响因素分析判断,掌握反应特征和图象信息是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | CH3OH | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、蔗糖都是电解质 | D. | 分馏、干馏都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| B. | 发酵粉中含有的碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| C. | Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等 | |
| D. | 明矾能水解生成Al(OH)3胶体,常用作生活用水的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com