
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
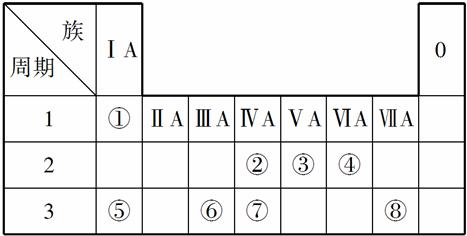
(1)④、⑤、⑥的原子半径由大到小的顺序为______________________。
(2)②、③、⑦三种元素的非金属性由强到弱的顺序是____________________。
(3)①、④、⑤、⑧中的三种元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:__________________。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
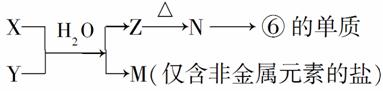
X溶液与Y溶液反应的离子方程式为______________________________,N→⑥的单质的化学方程式为____________________________。
科目:高中化学 来源: 题型:
下列物质中难溶于水且比水轻的含氧有机物是( )
①硝基苯 ②甲苯 ③溴苯 ④植物油 ⑤甲酸 ⑥乙酸乙酯 ⑦硬脂酸甘油酯
A.①②③ B.④⑥⑦
C.①②④⑤ D.②④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
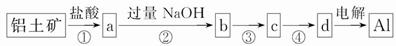
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( )
A.X与Y可能形成共价化合物XY
B.X与Y一定位于同一周期
C.X与Y不可能位于同一主族
D.X与Y不可能形成离子化合物XY
查看答案和解析>>
科目:高中化学 来源: 题型:
关于晶体的下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件的改变都能使化学反应:A(g)+B(g)C(g)+D(g)的反应速率发生改变,但其中变化的实质与“浓度改变对反应速率影响”相同的是( )
A.光照 B.温度
C.压强 D.催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
0.4 mol CuCl2溶于水,配成1 L溶液,用石墨电极进行电解,当一个电极得到0.3 mol Cu时,另一个电极上生成的气体在标准状况下的体积是( )
A.5.6 L B.6.72 L
C.3.36 L D.11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
2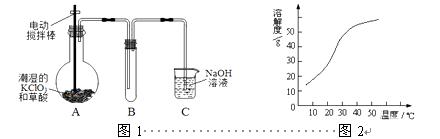
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;(2)NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com