
【题目】(1)明矾净水原理___________________________________(离子方程式表示),胶体具有________________性。
(2)在25℃时,将pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为___________
(3)NH4Cl溶液显______________(填“酸性”、“中性”或“碱性”),理由是_________(用离子方程式或必要的文字说明).
(4)NaHCO3溶液中,下列表述正确的是_______
A.c(Na+) + c(H+)= c(HCO3﹣)+ c(CO32﹣)+ c(OH﹣)
B. c(OH﹣)= c(H2CO3)+ c(H+)-c(CO32﹣)
C.c(OH﹣)= c(HCO3﹣)+ c(H+)+c(H2CO3)
D.c (Na+)= c(HCO3﹣)+ c(CO32﹣) + c(H2CO3)
【答案】Al3++3H2O ![]() Al(OH)3 +3H+ 吸附性 1:9 酸性 NH4++H2O
Al(OH)3 +3H+ 吸附性 1:9 酸性 NH4++H2O ![]() NH3·H2O+H+ BD
NH3·H2O+H+ BD
【解析】
可根据溶液混合反应后剩余c(OH-)浓度列式求解;根据水解原理分析溶液的酸碱性;根据物料守恒、质子守恒和电荷守恒比较溶液中离子浓度大小。
(1)明矾净水原理是由于铝离子发生了水解反应,离子方程式为:Al3++3H2O ![]() Al(OH)3 +3H+;胶体具有吸附性;
Al(OH)3 +3H+;胶体具有吸附性;
故答案为:Al3++3H2O ![]() Al(OH)3 +3H+,吸附性;
Al(OH)3 +3H+,吸附性;
(2) 设以下标1表示酸,2表示碱,则混合前碱中c2(OH-)=0.1 mol·L-1,酸中c1(H+)=0.01 mol·L-1,则:c余(OH-)=10-3mol·L-1=![]() =0.001;解得V2∶V1=1∶9,
=0.001;解得V2∶V1=1∶9,
故答案为:1∶9;
(3)NH4Cl属于强酸弱碱盐,溶液显酸性;理由是发生了水解反应,离子方程式为:NH4++H2O ![]() NH3·H2O+H+,
NH3·H2O+H+,
故答案为:酸性,NH4++H2O ![]() NH3·H2O+H+;
NH3·H2O+H+;
(4)NaHCO3溶液中,下列表述正确的是_______
A.根据电荷守恒得:c(Na+) + c(H+)= c(HCO3﹣)+2 c(CO32﹣)+ c(OH﹣),故A错误;
B.根据质子守恒的:c(H+) = c(OH﹣) + c(CO32﹣) -c(H2CO3) 即 c(OH﹣)= c(H2CO3)+ c(H+)-c(CO32﹣) ,故B正确;
C.根据质子守恒得:c(OH﹣)= c(H2CO3)+ c(H+)-c(CO32﹣),所以c(OH﹣)= c(HCO3﹣)+ c(H+)+c(H2CO3) 错误,故C错误;
D.根据物料守恒得:c (Na+)= c(HCO3﹣)+ c(CO32﹣) + c(H2CO3),故D正确;
故答案为:BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)等质量的二氧化硫和二氧化碳,它们的物质的量之比___,所含原子数之比为___,同温同压下的密度之比为___。
(2)有氢原子数相等的甲烷和氨气(NH3)的质量之比为___。
(3)3.22g的Na2SO4·10H2O溶于水中,要使每100个分子中含有1个Na+,则需要水的质量为___。
(4)同温同压下某容器充满氮气重64g,充满氦气重52g,现在充满某气体重66g,则该气体的摩尔质量为___。
Ⅱ.(1)油画所用颜料含有某种白色铅化物,此颜料置于空气中长时间后就会变成黑色PbS,从而使油画的色彩变暗,若用双氧水H2O2来清洗,则可将PbS变成PbSO4,从而使油画复原。上述清洗反应的化学方程式为PbS+4H2O2=PbSO4+4M(已配平)。
生成物M的化学式为___ ;若发生转移的电子数目4mol时,参加反应的H2O2的质量为___。
(2)在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O中,氧化剂是___,氧化产物是___,氧化产物与还原产物物质的量之比是___,氧化剂和还原剂的物质的量之比为___,若有36.5gHCl被氧化,则产生Cl2的质量为___。
(3)2.3g的金属钠,在干燥的空气中被氧化后得到固体的质量为3.5g,则反应后固体中氧化钠的质量为___。
(4)配平下列方程式并用单线桥表示电子的转移(不需写出配平过程)___
Cu+HNO3(稀)=Cu(NO3)2+NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。

(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯乙酸(ClCH2-COOH)在有机合成中是一种重要的原料和中间体,在硫单质催化下干燥氯气与乙酸反应制得一氯乙酸:![]()
![]()
![]()
已知:

请回答下列问题:
(1)选用下图的装置制备一氯乙酸粗品。

①按照气流从左至右依次连接的合理顺序为____→____→____→____→____→i→j→g→h(填接口字母)。____
②洗气瓶中的溶液为____,碱石灰的作用是____。
(2)制备一氯乙酸时,首先采用____(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹、____(填操作),如果三颈烧瓶溶液表面观察到大量 ___(填现象)时,应该___(填操作),以减少氯气通入量,以免浪费。
(3)一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有少量的____(填物质名称),再进行____(填“过滤”、“分液”或“重结晶”),可得到纯净的一氯乙酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内最新研究,实现CO2的固定和储能的多功能电化学反应装置,如图所示。该装置充放电过程并不完全可逆,即充电过程C不参与反应。放电过程反应方程式为:4Li+3CO2=2Li2CO3+C,下列叙述正确的是
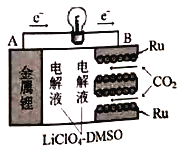
A. 放电过程正极反应式为4Li++3CO2+4e-=2Li2CO3+C
B. 若放电过程转移电子物质的量为0.2mol,理论上可以固定C的质量为1.2g
C. 充电过程B电极为阴极,发生氧化反应
D. 可用 LiClO4水溶液代替LiClO4-DMSO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W在工业上常用作溶剂和香料,其合成方法如图,下列说法不正确的是

A. M、N、W均能发生加成反应和取代反应
B. N、W组成上相差一个CH2原子团,所以互为同系物
C. 1molM与1molw完全燃烧消耗O2的物质的量相同
D. M苯环上的二氯代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的数值,下列叙述错误的是( )
A.标准状况下,11.2 L氦气中含有0.5 NA原子
B.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0.2 NA
C.常温常压下,18g H2O 所含的中子数为8NA
D.1mol铝分别和足量的氢氧化钠溶液和硫酸溶液反应转移的电子都3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com