
| A. | S(g)+O2(g)═SO2(g)△H<-297.3kJ•mol-1 | |
| B. | 2SO2(g)═2S(s)+2O2(g)△H=+297.3kJ•mol-1 | |
| C. | 1molSO2的键能总和小于1molS和1molO2的键能总和 | |
| D. | 1molSO2具有的总能量大于1molS和1molO2的总能量 |
分析 A、因物质由固态转变成气态也要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的绝对值大于297.23kJ•mol-1,焓变为负值比较大小;
B、S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,反应的逆反应2SO2(g)═2S(s)+2O2(g)△H=+297.3×2kJ•mol-1 =594.62kJ•mol-1;
C、反应焓变△H=反应物总键能之和-生成物总键能总和,反应为放热反应,△H<0;
D、反应为放热反应,所以反应物的总能量高于生成物的总能量.
解答 解:A、因物质由固态转变成气态也要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的绝对值大于297.23kJ•mol-1,焓变为负值,△H<-297.3kJ•mol-1,故A正确;
B、S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,反应的逆反应2SO2(g)═2S(s)+2O2(g)△H=+297.3×2kJ•mol-1 =594.62kJ•mol-1,故B错误;
C、反应焓变△H=反应物总键能之和-生成物总键能总和,反应为放热反应,△H<0,所以1molSO2的键能总和大于1molS和1molO2的键能总和,故C错误;
D、反应为放热反应,所以反应物的总能量高于生成物的总能量,即1molS(s)与1molO2(g)所具有的能量之和高于1molSO2(g)所具有的能量,故D错误.
故选:A.
点评 本题考查反应热与物质状态的关系、反应热与物质能量的关系,难度不大,注意化学反应中反应热的计算,物质三态之间的转变也存在能量的变化.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题

 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH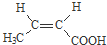 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的 体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8KJ•mol-1 | |
| D. | H2(g)+O2(g)═H2O(g)△H=-285.8KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3kJ/mol. | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+KNO3(aq)△H<-57.3kJ/mol. | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3kJ/mol. | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H>-57.3kJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 7 0℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com