
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
(1)烃A的分子式为__________.
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则燃烧时消耗标准状况下的氧气____________L.
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为_____________.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式有三种,它们分别为________、________、_____.
【答案】C6H12100.8![]() (CH3)3C﹣CH=CH2CH3C(CH3)=C(CH3)﹣CH3CH3CH(CH3)﹣C(CH3)=CH2.
(CH3)3C﹣CH=CH2CH3C(CH3)=C(CH3)﹣CH3CH3CH(CH3)﹣C(CH3)=CH2.
【解析】
(1)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol,说明1个烃分子中含有6个碳原子和12个氢原子,分子式为C6H12。(2) 若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,说明该烃的物质的量为0.5mol,根据方程式C6H12+9O2=6CO2+6H2O分析,消耗4.5mol氧气,标况下体积为22.4×4.5=100.8L; (3) 若烃A不能使溴水褪色,说明没有不饱和键,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,说明结构对称性很强,只有一种碳原子和一种氢原子,所以结构为 ![]() ; (4) 若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,结构可能为(CH3)3C﹣CH2CH3或(CH3)2CHCH(CH3)2,所以烃A可能有的结构简式有三种:(CH3)2C﹣CH=CH2、(CH3)2C=C(CH3)2 ,CH3CH(CH3)﹣C(CH3)=CH2。
; (4) 若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,结构可能为(CH3)3C﹣CH2CH3或(CH3)2CHCH(CH3)2,所以烃A可能有的结构简式有三种:(CH3)2C﹣CH=CH2、(CH3)2C=C(CH3)2 ,CH3CH(CH3)﹣C(CH3)=CH2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构:
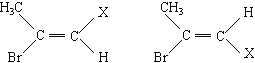
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构式可能为:____________________、____________________;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在______种不同的结构:其结构式为:_________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇的分子结构如图:其中 ①②③④⑤表示化学键代号,用代号回答:
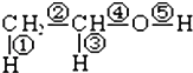
(1)乙醇与钠反应断裂的键是_______;
(2)乙醇与浓硫酸共热到170℃制乙烯,断裂的键是_______;
(3)乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是_________;
(4)乙醇与乙酸在浓硫酸作用下反应断___________键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
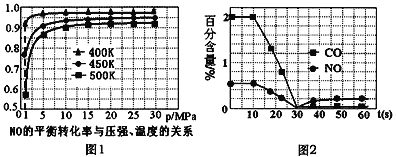
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。
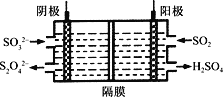
(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
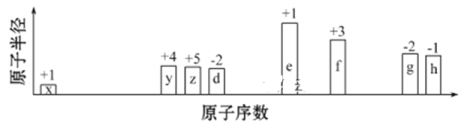
根据判断出的元素回答问题:
(1) f在周期表中的位置是__________。
(2) 比较d、e常见离子的半径大小(用化学式表示,下同):____>____;比较g、h的最高价氧化物对应水化物的酸性强弱:____>____。
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式:____。
(4)f和h形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该化合物是_______(填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________。
(5) 上述元素可组成盐R: zx4f(gd4)2,向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
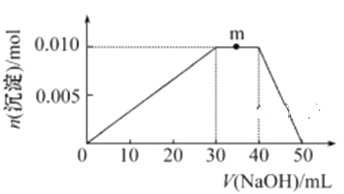
①m点反应的离子方程式: ________________。
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________,它的VSEPR模型名称____________,分子的立体构型为_____________。
(3)与分子晶体D2B3互为等电子体的一种分子为____________(填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______(填化学式,下同),酸性最强的是_________________。
(5)单质B有两种同素异形体,其中沸点高的是______(填分子式),原因是__________。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________。
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
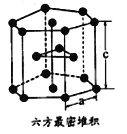 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等质量的锌片和铜片用导线相连插入500 mL CuSO4溶液中构成如图所示的装置。
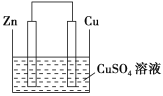
(1)该装置为____装置,该装置中发生反应的总离子方程式为____,铜片周围溶液会出现________的现象。
(2)若2 min后测得锌片的质量减少1.3 g,则导线中流过的电子为_____mol。
(3)若该装置的电解质溶液换为FeCl3溶液,其正极反应为_______。
Ⅱ.向2L密闭容器中通入amol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g)![]() pC(g)+qD(g)。已知:平均反应速率v(C)=
pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2min时,A的物质的量减少了
v(A);反应至2min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() amol/L,同时有amolD生成。
amol/L,同时有amolD生成。
(4)0~2 min内,v(A)=__________。
(5)该化学方程式中,y=__________。
(6)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率____(填“增大”、“减小”或“不变”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
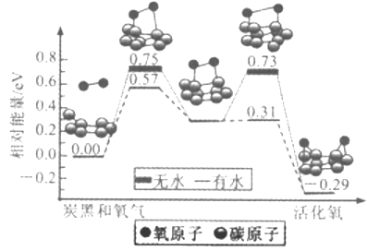
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com