
| A、还原剂是KNO3和S |
| B、当有12mol电子转移时,有3 mol C被还原 |
| C、1 mol S能氧化0.5 mol C |
| D、当有1mol KNO3参加反应时,有7.224×1024个电子发生转移 |
| 1mol×2 |
| (4-0) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 91:9 | 1:l | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应 | ||||
| B、CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物 | ||||
| C、铝热反应是指铝能将所有的金属从其氧化物中置换出来 | ||||
D、CaCO3+SiO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非电解质:C6H12O6、Cl2、C2H5OH |
| B、酸性氧化物:CO2、SO2、SiO2 |
| C、混合物:铝热剂、淀粉、漂白粉 |
| D、同素异形体:C60、C70、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与氯化亚铁溶液常温下混合 |
| B、一氧化碳通过灼热的三氧化二铁 |
| C、氢气通入硫酸亚铁溶液 |
| D、铝和四氧化三铁混合加热到高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
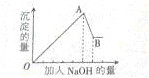 有一无色溶液,可能含有Fe3+,Al3+,Mg2+,Cu2+,NH4+,K+,CO32-,SO42-,NO3-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
有一无色溶液,可能含有Fe3+,Al3+,Mg2+,Cu2+,NH4+,K+,CO32-,SO42-,NO3-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:| 主要实验内容 | 现 象 | |
| ① | 焰色反应(透过蓝色钴玻璃) | 紫色火焰 |
| ② | 先加入稀盐酸后加BaCl2溶液 | 无气体产生,但是出现白色沉淀 |
| ③ | 逐滴加入NaOH溶液至过量 | 生成白色沉淀的量与加入NaOH的量的关系如下图所示 |
| ④ | 加入足量Na2O2粉末 | 生成无色无味气体,白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com