
����Ŀ��A��B��C��D��E��F���ֻ��������A��B��C��D��E���ɶ�����Ԫ����ɣ���ɫ��Ӧ��Ϊ��ɫ��B��C��E��������Ԫ����ɣ�B��C�����Ԫ����ͬ����C��Ħ��������B��80g/mol���ش�
��1�����廯����AΪdz��ɫ��ĩ���û������к��еĻ�ѧ��Ϊ_______
A.���Ӽ� B.���Թ��ۼ� C.�Ǽ��Թ��ۼ� D.���
��2���±�ΪB��Fʵ��IJ�������
���ں�B����Һ�м���ϡH2SO4������dz��ɫ���Ǻ�ʹ����ʯ��ˮ����ǵ���ɫ�д̼�����ζ������ |
��20mL��ˮ�еμ�F�ı�����Һ1��2mL����Һ��ʺ��ɫ�����ü���������ж����ЧӦ�� |
д��B��ϡH2SO4��Ӧ�����ӷ���ʽ________
д�����з�Ӧ�Ļ�ѧ����ʽ________
��3������6������Mn2+��MnO 4-��H+��H2O��X2Y 82-��C�к��е������ӣ���XY 42-���һ�����ӷ���ʽ����֪Mn2+Ϊ��ԭ�����õ�1mol MnO 4- �������������ʵ���Ϊ________ mol
��4��������D��E�ת��D ![]() E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊ________ g��ExH2O�Ļ�ѧʽΪ________��
E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊ________ g��ExH2O�Ļ�ѧʽΪ________��
���𰸡� AC S2O32��+2H+=S��+SO2��+H2O FeCl3+3H2O ![]() Fe��OH��3�����壩+3HCl 2.5 8.4 Na2C037H2O
Fe��OH��3�����壩+3HCl 2.5 8.4 Na2C037H2O
��������(1)A��B��C��D��E���ɶ�����Ԫ���������ɫ��Ӧ���ʻ�ɫ��������NaԪ�������廯����AΪdz��ɫ��ĩ�����ǹ������������������к������Ӽ��ͷǼ��Լ�����ȷ��:AC��
(2)����������֪��F���Ȼ�����Һ������������֪��B��![]() ��B�����ᷴӦ�ķ���ʽΪ: S2O32��+2H+=S��+SO2��+H2O ����������������������Ʊ�������ʽΪ��FeCl3+3H2O
��B�����ᷴӦ�ķ���ʽΪ: S2O32��+2H+=S��+SO2��+H2O ����������������������Ʊ�������ʽΪ��FeCl3+3H2O ![]() Fe��OH��3�����壩+3HCl�� ��ȷ����S2O32��+2H+=S��+SO2��+H2O �� FeCl3+3H2O
Fe��OH��3�����壩+3HCl�� ��ȷ����S2O32��+2H+=S��+SO2��+H2O �� FeCl3+3H2O ![]() Fe��OH��3�����壩+3HCl��
Fe��OH��3�����壩+3HCl��
(3)![]() ����������
����������![]() �����ϼ�����5����λ����������
�����ϼ�����5����λ����������![]() ���仹ԭ������
���仹ԭ������![]() ,
,![]() �������õ�
�������õ�![]() ���������Ը��ݵ��ӵĵ�ʧ�غ����֪������Ҫ�����������ʵ�����
���������Ը��ݵ��ӵĵ�ʧ�غ����֪������Ҫ�����������ʵ�����![]() ����ȷ��: 2.5 ��
����ȷ��: 2.5 ��
(4)����ת������֪��D��̼��������EΪ̼������Ũ�������ӵ���������ˮ�����������ʵ����� ����ʯ�����ӵ�������
����ʯ�����ӵ�������![]() ������������
������������![]() �����ʵ�����
�����ʵ�����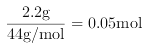 ���û������ֻ��̼�����Ƽ��ȷֽ����������̼��������˸��ݷ�Ӧ2NaHCO3=Na2CO3+CO2��+H2O�ó�NaHCO3�����ʵ�����
���û������ֻ��̼�����Ƽ��ȷֽ����������̼��������˸��ݷ�Ӧ2NaHCO3=Na2CO3+CO2��+H2O�ó�NaHCO3�����ʵ�����![]() ��������
��������![]() ������ˮ����Ϊ0.05mol������Na2C03XH2O��������
������ˮ����Ϊ0.05mol������Na2C03XH2O��������![]() �����Na2C03XH2O�нᾧˮ�����ʵ�����
�����Na2C03XH2O�нᾧˮ�����ʵ�����![]() ��������
��������![]() ������Na2C03XH2O��Na2C03��������
������Na2C03XH2O��Na2C03��������![]() �������ʵ�����
�������ʵ�����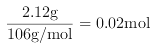 ,��
,��![]() ����EH2O�Ļ�ѧʽΪNa2C037H2O����ȷ��: 8.4 �� Na2C037H2O��
����EH2O�Ļ�ѧʽΪNa2C037H2O����ȷ��: 8.4 �� Na2C037H2O��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ������з�����ӦCO��g��+H2O��g��CO2��g��+H2��g�����������ݼ���������t2��t1����˵��������ǣ� ��
��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol | n��CO2��/mol | n��H2��/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
A.��Ӧ��t1minĩ������Ϊv��H2��=0.2/t molL��1min��1
B.ƽ��ʱˮ������ת����Ϊ66.67%
C.���¶��·�Ӧ��ƽ�ⳣ��Ϊ1
D.�����������䣬����ʼʱ��n��CO��=0.60 mol��n��H2O��=1.20 mol����ƽ��ʱˮ������ת����Ϊ33.33%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������ƺ������Ƶ���������ȷ����
A. ������������Ӧ B. ����ˮ��������Һ�ijɷ���ͬ
C. ������ˮ�������Ϸ�Ӧ D. �ֱ��������̼��Ӧ�����ɲ�ͬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ��ú�������������Ϊ0.32%���ù���ÿ��ȼ������ú10t�����㣺
��1�����ú�е���ȫ��ת��ΪSO2 �� ÿ��ɲ�����SO2������Ϊ����t��
��2����ЩSO2�ڱ�״���µ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ���������Ԫ�أ�ԭ��������A��E������AԪ�������������Ǵ�����������2������B�������Ӻ�C������������ԭ�ӵĵ��Ӳ�ṹ��ͬ������ͨ��״���£�B�ĵ��������壬0.1mol B��������������������ȫ��Ӧ����0.4mol����ת�ƣ���C�ĵ����ڵ�ȼʱ��B�ĵ��ʳ�ַ�Ӧ�����ɵ���ɫ�Ĺ��壬�˵���ɫ��������AB2��Ӧ������B�ĵ��ʣ���D����̬�⻯��������ۺ�������ܷ���������ԭ��Ӧ����д����
��1��AԪ�ص����������Ľṹʽ��BԪ�������ڱ��е�λ�� ��
��2��C������B������ȼ�յ���������������ѧ����������C��D ���γɻ�����ĵ���ʽ ��
��3��DԪ�صĵͼ���������E�ĵ��ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��4��Ԫ��D��Ԫ��E��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ��������ѡ����ţ��� a��������D�ĵ��ʺ�E�ĵ���״̬��ͬ b��E���⻯���D���⻯���ȶ�
c��һ��������D��E�ĵ��ʶ������Ʒ�Ӧ d��D����ۺ�������������E����ۺ�����
e��D�ĵ�������E���⻯�ﷴӦ����E���ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ��õļ�������غ����������أ�K2O�����������أ�K2O2���ͳ������أ�KO2���ȶ��ֻ����
��1���غ�����ط�Ӧ���Ƶ�K2O��10K+2KNO3��6K2O+N2����39.0g����10.1g����س�ַ�Ӧ����K2O������Ϊg��
��2��ij����������Ʒ�������������������ʲ�������Ϊ0.28������Ʒ��K2O2����������Ϊ ��
��3���������غͶ�����̼��Ӧ����������4KO2+2CO2��2K2CO3+3O2������ҽԺ����DZˮ���߿շ�����������������13.2L����״����CO2��KO2��Ӧ�����������Ϊ18.8L ����״���������㷴Ӧ���ĵ�KO2��������
��4��KO2������600�沿�ַֽ�õ�����A��6.30g����A������ն�����̼����̼��ز���������1.12L����״��������ȷ������A�м�������ԭ�Ӹ���֮�ȣ��������Aֻ�������ֻ����д�����п��ܵĻ�ѧʽ������A�����ֻ���������ʵ���֮�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ��������������ʵ�ת����ϵ��ͼ��ʾ�����мס���Ϊ���ʣ�������Ϊ����� 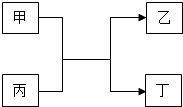
������ҵ���ø÷�Ӧ�ƴֹ�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�����÷�Ӧ�����ں��������ұ�Ϊ����ɫ������÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
������Ϊ���д��Եĺ�ɫ����д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
������Ϊ����ɫ���壬�Ҹ÷�Ӧ�������鹤ҵ�ϼ��Ƿ�й©��д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʽΪC3H6Cl2���л��������һ����ԭ�ӱ���ԭ��ȡ��������������ֿ��ܵĽṹ��ԭ�л���Ľṹ��ʽΪ��������
A.CH2Cl��CH2��CH2Cl
B.CHCl2��CH2��CH3
C.CH2Cl��CHCl��CH3
D.CH3��CCl2��CH3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com