
已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3
C.1∶4 D.2∶3
科目:高中化学 来源: 题型:
下列所示实验合理的是( )

A.图1用于证明非金属性强弱
B.图2用于制备少量氧气
C.图3用于配制100 mL一定浓度硫酸溶液
D.图4用于制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~丁在元素周期表中的相对位置如右表所示:
 下列判断正确的是( )
下列判断正确的是( )
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在下图装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是( )
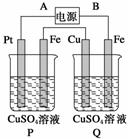
A.直流电源中,A是正极
B.两池内CuSO4溶液浓度均不改变
C.两铁极上最初析出物相同
D.P池内溶液的质量逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
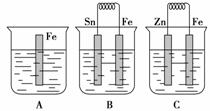
(1)A中反应的离子方程式为_____________________________________________。
(2)B中Sn极的电极反应式为__________________________________________,
Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)C中被腐蚀的金属是________,总反应的离子方程式为________________________________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把煤作为燃料可通过以下两种途径,途径Ⅰ:C(s)+O 2(g)===CO2(g);ΔH1<0。途径Ⅱ:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g);ΔH2>0,再燃烧水煤气:2CO(g)+O2(g)===2CO2(g);ΔH3<0,2H2
2(g)===CO2(g);ΔH1<0。途径Ⅱ:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g);ΔH2>0,再燃烧水煤气:2CO(g)+O2(g)===2CO2(g);ΔH3<0,2H2 (g)+O2(g)===2H2O(g);ΔH4<0。
(g)+O2(g)===2H2O(g);ΔH4<0。
请回答下列问题:
(1)比较两种途径的放热情况:途径Ⅰ放出的热量__ __(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3和ΔH4的数学关系式是____________。
(3)由于制取水煤气的反应中,反应物具有的总能量____
生成物具有的总能量,那么在进行化学反应时,反应物就需要________能量才能转化为生成物, 因此其反应条件是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)、C2H4(g)和C2H5OH(l)的燃 烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为
烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2.3 g纯净金属钠在干燥空气中被氧化后得到3.5 g固体,由此可判断其氧化产物是( )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com