
����Ŀ������![]() ������Ϊ�����������ȼ�ϣ�NH3��NaClO��Ӧ�ɵõ��¡�
������Ϊ�����������ȼ�ϣ�NH3��NaClO��Ӧ�ɵõ��¡�
��1��ʵ�������Ȼ�狀����������Ʊ������Ļ�ѧ����ʽ��__________________
��2����֪����N2��g��+2O2��g��=N2O4��l�� ��H1����195kJ��mol��1
��N2H4��l��+O2��g��=N2��g��+2H2O��g�� ��H2����534kJ��mol��1
д��Һ̬�º�N2O4��l����Ӧ����N2��ˮ�������Ȼ�ѧ����ʽ��__________________
��3����֪����1 mol��ѧ�������������kJ�����£�N��NΪ942��O=OΪ498��N-NΪ154��H-OΪ464�������N2H4��l�� +O2��g��= N2��g�� +2H2O��g�� ��H2����534kJ��mol��1�����ݼ������1 molN-H�������������kJ���ǣ�__________________
��4��д��NH3��NaClO��Ӧ�õ��µĻ�ѧ����ʽ��____________________
���𰸡���1��2NH4Cl��Ca��OH��2![]() CaCl2��2NH3����2H2O
CaCl2��2NH3����2H2O
��2��2N2H4��l��+N2O4��l��=3N2��g��+4H2O��g�� ��H����873kJ��mol��1
��3��403
��4��2NH3+NaClO=N2H4+NaCl+H2O
��������
�����������1��ʵ�������Ȼ�狀��������Ƽ����Ʊ������Ļ�ѧ����ʽ��2NH4Cl��Ca��OH��2![]() CaCl2��2NH3����2H2O�����ݸ�˹�������ڡ�2������Һ̬�º�N2O4��l����Ӧ����N2��ˮ�������Ȼ�ѧ����ʽ2N2H4��l�� + N2O4��l�� = 3N2��g�� +4H2O��g�� ��H����873kJ��mol��1����3���ʱ�=��Ӧ����ܼ���-��������ܼ�������534kJ��mol��1=154+4x+498��942��464��4��x=403����4��NH3��NaClO��Ӧ�õ��µĻ�ѧ����ʽ2NH3+NaClO= N2H4+NaCl+H2O��
CaCl2��2NH3����2H2O�����ݸ�˹�������ڡ�2������Һ̬�º�N2O4��l����Ӧ����N2��ˮ�������Ȼ�ѧ����ʽ2N2H4��l�� + N2O4��l�� = 3N2��g�� +4H2O��g�� ��H����873kJ��mol��1����3���ʱ�=��Ӧ����ܼ���-��������ܼ�������534kJ��mol��1=154+4x+498��942��464��4��x=403����4��NH3��NaClO��Ӧ�õ��µĻ�ѧ����ʽ2NH3+NaClO= N2H4+NaCl+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g)�����¶ȴ�300������400������Ӧ���´ﵽƽ��ʱ��H2������������������й��ڸù��̵��ж���ȷ����
CH4(g) + 2H2O(g)�����¶ȴ�300������400������Ӧ���´ﵽƽ��ʱ��H2������������������й��ڸù��̵��ж���ȷ����
A. �÷�Ӧ����H < 0 B. ��ѧƽ�ⳣ��K����
C. CO2��ת�������� D. ����Ӧ���������淴Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ���ѽ���Ϊԭ�ϣ�ͨ��һϵ�л�ѧ��Ӧ�ɵõ���Ҫ�Ļ�����Ʒ���ܼ�G��

��������и��⣺
��1��д����Ӧ���ͣ���Ӧ��__________________����Ӧ��____________________��
��2��д����Ӧ��������Ӧ��__________________��
��3����Ӧ�ڢ۵�Ŀ���ǣ�________________________________________________��
��4��д����Ӧ�ݵĻ�ѧ����ʽ��__________________________________________��
��5��B��������C�Ĺ����л����м�������ɣ���������ʴ��ڵ��Լ���_______________________________________________��
��6��1,3-����ϩ��һ������H2��һ�������µļӳɲ����д���˳���칹��д��˳ʽ����ṹ��ʽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.25Ħ���������У����е���ԭ�Ӹ���ԼΪ
A.1B.0.25C.6.02��1023D.5��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ij��ѧ����С��������ͼһװ����ȡ�屽�������Һ©���м��뱽��Һ�壬�ٽ����Һ�������뷴Ӧ��A��A�¶˻����رգ��С�

��1���۲쵽A�е�������_________________��
��2��ʵ�����ʱ����A�¶˵Ļ������÷�ӦҺ����B�У������ д���йط�Ӧ�Ļ�ѧ����ʽ _________________��
��3��C��ʢ��CCl4��������_____________________________________________��
��4����֤������Һ�巢������ȡ����Ӧ�������Ǽӳɷ�Ӧ�������Թ�D�м���AgNO3��Һ������������ɫ����������֤������һ����֤�ķ����� ______________________________��
II.ʵ�����Ʊ�����������Ҫ�������£�������һ��������Ũ������Ũ����Ļ���ᣬ���뷴Ӧ���У����������µĻ��������μ���һ�����ı����������Ͼ��ȣ�����50��60���·�����Ӧ��ֱ����Ӧ�������ܳ�ȥ�����ֲ�Ʒ����������ˮ��5%NaOH��Һϴ�ӣ������������ˮϴ�ӣ��ݽ�����ˮCaCl2�����Ĵ��������������õ��������������� ����д���пհף�
��1������һ������Ũ�����Ũ��������ʱ����ȷ������___________________________��
��2��������У�Ϊ��ʹ��Ӧ��50��60���½��У����õķ�����_________________________��
��3��������дֲ�Ʒ��5%NaOH��Һϴ�ӵ�Ŀ���� _________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����볣��(Ka��Kb)���ܶȻ�����(Ksp)���ж��������ʵ���Ҫ���������й�����Щ�����ļ����������ȷ���ǣ� ��
A. ij��������ҺpH=4.3�������Զ������룬����һ������ƽ�ⳣ��K1=1.0��10-8.60
B. Ka(HCN)<Ka(CH3COOH)��˵��ͬŨ��ʱ����������Աȴ���ǿ
C. Ksp(AgI)<Ksp(AgCl)����AgCl����Һ�м���KI��Һ����ֻ�ɫ����
D. Ksp(AgCl)<Ksp(AgOH)��˵��AgOH��AgCl��������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ʯīϩ�;���ճ���Եľ۹���֬(�׳���Ƥ��)�Ʊ���һ�־��м��� �����ȵĵ���ѧ���в��ϣ��ܹ�������ı��κͳ�����������̶�������̽�֩����˶����ò��Ͽ����������������������Ѫѹ�Ĵ������ȡ�ʵ����ģ�ҵ�ϳɷ������Ʊ��۹���֬���м����ȼ�������������ClCH2Si(OEt)3 ����ȡ20mL�����ȹ���(CH3SiCl3)ע��������ƿ�У�������Ž��������������66�棬��a�м���Ũ���ᣬ����Aһ��ʱ�䣬���¶�����110�棬ֹͣ���ȣ���������ƿ�м���30mL��ˮ�Ҵ�(EtOH)��Ѹ�ٷ�Ӧ�����ȼ�������������ClCH2Si(OEt)3�����¶Ƚ������º�������ƿ��Һ��ת�Ƶ�������ƿ�������ռ��õ�174.5�����12mL��
���� | C2H5OH | CH3SiCl3 | ClCH2SiCl3 | ClCH2Si(OEt)3 |
��Է������� | 46 | 149.5 | 184 | 212.5 |
�۵�/�� | ��114.1 | ��77.8 | �� | �� |
�е�/�� | 78.3 | 66.4 | 116.5 | 174 |
�ܶ�/g��mL | 0.79 | 1.30 | 1.47 | 1.02 |
��֪�������ȹ���Ϊ��ɫҺ�壬���д̱Ƕ�����׳��⣻�ȼ���������������ˮ�⣬�������������������ɼ�����贼�Ρ�

(1)���Ӻ�װ�ú���װ�������ԵIJ����ǣ�_________________________________��
(2)Aװ���з�����Ӧ�����ӷ���ʽ�ǣ�_______________________________________��
װ��C�������ǣ�_____________________ ��E����װҺ���ǣ�______________��
(3)װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ���� CH3SiCl3 + Cl2 �� ClCH2SiCl3 + HCl
��__________________________________________________________________ ��
���������ܵ������ǣ�________________________��
(4)��ͬѧ���ָ�װ����һ��������ܻᵼ��ʵ��ʧ�ܣ�Ӧ��__________________________________________________��
(5) �÷����Ʊ��ȼ�������������IJ����ǣ�_______________(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������[KAl��SO4��2��12H2O]���������������й㷺��;������ˮ�ľ�������ֽ��ҵ����ʩ������ʳƷ��ҵ�ķ��ͼ��ȣ������������ķ��ϩ����ң���Al��Al2O3������SiO2��FeO��xFe2O3�����Ʊ������������������£�
�ش��������⣺

��1��������ˮ��ԭ���ǣ������ӷ��̱�ʾ��________________��
��2����������________��������������Ũ����________�����ˡ�ϴ�ӡ����
��3��������ҺA���Ƿ����Fe2+���Լ���________��ֻ��һ���Լ���
��4������ҺA�м��������ط�����Ӧ�����ӷ���ʽΪ����������Fe2+ ת��ΪFe3+��MnO4��ת��ΪMn2+��________________��
��֪�������������������pH���±���ʾ
Al��OH��3 | Fe��OH��2 | Fe��OH��3 | |
��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
ע���������ӵ���ʼŨ��Ϊ0.1mol��L��1
���ݱ������ݽ��͵�pH=3��Ŀ��________________��
��5����֪����pH=3�����������£�MnO4������Mn2+��Ӧ����MnO2������MnSO4������Ӧ�����ӷ���ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.0 mL 0.10 mol/L��ˮ�е���0.10 mol/L�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ(�����������ݳ�)�������й�������ȷ����( )
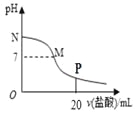
A. M��N��һ�����ڣ�c(Cl��)>c(NH4+)>c(OH��)>c(H+)
B. M���Ӧ���������Ϊ10.0mL
C. pH=7����Һ�У�c(NH4+)=c(Cl��)=c(H+)=c(OH��)
D. P�㴦����Һ�д��ڣ�2c(NH4+)+2c(NH3��H2O)=c(Cl��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com