
【题目】常温下,将20.0g质量分数为14.0%的KHCO3溶液跟30.0g质量分数为24.0%的KHCO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数__________。
(2)混合后溶液的物质的量浓度________。
(3)在1000g水中需溶解___________摩尔KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等?
【答案】 20% 2.3 mol·L-1 2.5mol
【解析】(1)20.0g质量分数为14.0%的KHCO3溶液中溶质的质量m1=20.0g×14.0%=2.8g;30.0g质量分数为24.0%的KHCO3溶液溶质的质量m2=30.0g×24.0%=7.2g,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为![]() ×100%=20%,答:混合后溶液的质量分数为20%;
×100%=20%,答:混合后溶液的质量分数为20%;
(2)混合液中溶质的质量为2.8g+7.2g=10g,溶质的物质的量为n=![]() =0.1mol,溶液的体积为V=
=0.1mol,溶液的体积为V=![]() =
=![]() L,所以溶液的物质的量浓度为c=
L,所以溶液的物质的量浓度为c=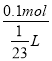 =2.3mol/L,答:混合后溶液的物质的量浓度为2.3mol/L;
=2.3mol/L,答:混合后溶液的物质的量浓度为2.3mol/L;
(3)设需要KHCO3的物质的量为xmol,KHCO3的质量为100x,根据(1)可知,KHCO3的质量分数为20%,则ω=20%=![]() =
=![]() ×100%,解得:x=2.5mol,答:在1 000g水中需溶解2.5mol KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等。
×100%,解得:x=2.5mol,答:在1 000g水中需溶解2.5mol KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示)。已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )
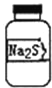
A. 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
B. 往溶液中加入稀盐酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
C. 用pH试纸检验,若pH=7,则固体M不一定是Na2SO4
D. 只用盐酸一种试剂不能确定该固体M的具体成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A. Na+ H+ NO3- Fe2+ B. Ca2+ H+ ClO- NO3-
C. K+ H+ Cl- SO42- D. Fe3+ Cl- H+ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):
阳离子:H+、Na+、Al3+、Ag+、Ba2+
阴离子:OH-、Cl-、CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
请回答下列问题:
(1)写出A与D的化学式: A________,D________。
(2)写出A与E溶液反应的离子方程式:_______ 。
(3)已知:NaOH(aq)+HNO3(aq) = NaNO3(aq)+H2O(l) ΔH=-a kJ·mol-1。请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式: ________
(4)若25 ℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是________;将C与醋酸混合,醋酸的电离程度将________ (填“增大”“不变”或“减小”)(水的浓度视为常数)。
(5)用惰性电极电解0.1 mol·L-1 D与0.1 mol·L-1C各100 mL混合后的溶液,电解一段时间后,阴极质量________ (填“增大”“不变”或“减小”,下同);溶液的pH ________。
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AgNO3的水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示):______________;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于_______中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(用离子方程式表示)______________。把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是________。
(3)用热的纯碱溶液洗涤餐具,原因是(用离子方程式表示)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Ca2+、Mg2+、Cl—、SO42—等杂质,选择装置_____________(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___________________。
(3)装置A中①的名称是_____________,进水的方向是_____________。装置B在分液时为使液体顺利滴下,应进行的具体操作是_____________。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是_____________(填写字母)。
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦d.⑤②①③④⑥⑦
问题2:由海水到氯化钠晶体的实验过程中要用到的主要装置是_____________(从给定的四种装置中选择,填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列盐溶液的酸碱性,能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样。
K2CO3溶液呈 性 ;
K2SO4溶液呈 性 ;
FeCl3溶液呈 性 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com