
| A. | 64gSO2含有硫原子数为2NA | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | 标准状况下,22.4L的水含有 NA个水分子 |
分析 A.质量转化为物质的量,结合1个二氧化硫含有1个硫原子解答;
B.依据m=nNAM计算解答;
C.质量转化为物质的量,结合1个氮气分子含有2个氮原子解答;
D.气体摩尔体积使用对象为气体.
解答 解:A.A.64gSO2的物质的量为1mol,所含的硫原子的个数为NA,故A错误;
B.NA个氧分子质量为1mol,质量为32g,NA个氢分子物质的量为1mol,质量为2g,质量比等于16:1,故B正确;
C.28g氮气N2 的物质的量为1mol,所含的氮原子数目为2NA,故C错误;
D.标况下水是液体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
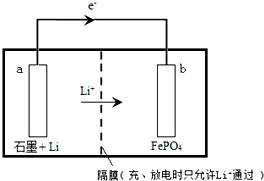 LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的还原性 | |
| C. | 采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
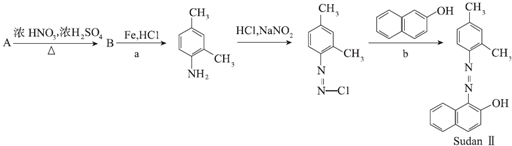
 .
.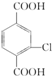 +4NaOH→
+4NaOH→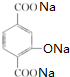 +NaCl+3H2O.②E→F
+NaCl+3H2O.②E→F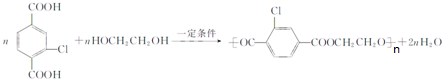 .
.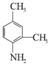 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
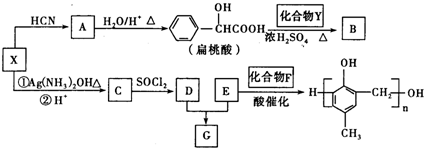
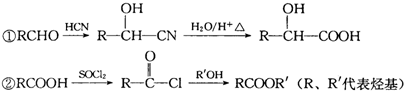
 .
.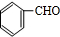 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +
+ .
.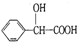 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 .
.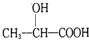 )的路线(其它试剂任选).
)的路线(其它试剂任选).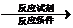 B…$→_{反应条件}^{反应试剂}$目标产物)
B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com