
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 0.5 mol H2SO4与0.5 mol Ba(OH)2完全反应生成BaSO4时放出的热叫做中和热 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 三种酸的酸性为HX<HY<HZ | |
| B. | 物质的量浓度相同的三种盐的水溶液中,NaZ的溶液中,水的电离程度最大 | |
| C. | pH值相同的三种酸的水溶液,恰好中和时所耗NaOH的物质的量为HX<HY<HZ | |
| D. | 物质的量浓度相同的HZ和NaX能发生HZ+NaX=HX+NaZ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
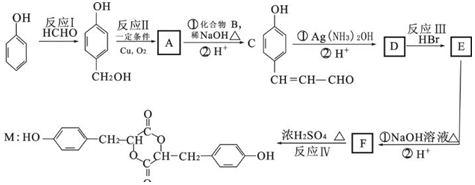
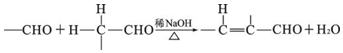
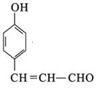 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O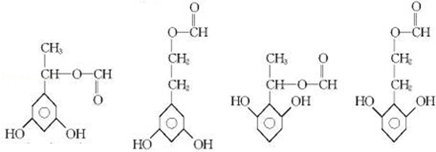 种.
种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com