
一定温度时,在容积一定的密闭容器中,反应A(?)+B(g)  C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A.体积分数组成C%=D%
B.单位时间内生成n molA的同时生成n molC
C.温度和体积一定时,某一生成物浓度不再变化
D.温度和体积一定时,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如图所示。t2时改了某种条件,改变的条件是 。(填写字母编号)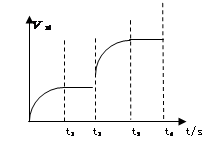
A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
(1)吸热 K=[ c(C)·c(D)]/ c(B) (2)BCD (3)B(4)40%
解析试题分析: (1)容积固定,升高温度,密度增大,说明气体质量增大,所以A为非气体。且正反应是放热反应。A为非气态,不列入平衡常数表达式。
(2)每生成1molC同时生成1molD,无论是平衡状态还是非平衡状态,C和D体积分数均相等,A错误;生成A和生成C分别为逆反应和正反应,且正、逆反应速率相等,是平衡状态,B正确;某一组分浓度不变说明是平衡状态,C正确;因A是非气态,反应前后气体物质的量变化,所以温度和体积一定时,气体压强不变的状态是平衡状态,D正确。
(3)新旧平衡不连续,不可能是改变浓度,D错误;催化剂对平衡移动无影响,C错误;t2后逆反应速率大于正反应速率,说明平衡向逆反应方向移动。因该反应是吸热反应,升高温度,平衡向右移动,A错误;A是非气态,增大压强,平衡向左移动,B正确。
(4)扩大容器体积等效于减小压强,由A的百分含量不变说明此条件下A是气体。设转化的B物质的量为x,K= =
=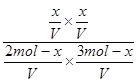 =1,解得x=1.2mol。B的转化率为0.4。
=1,解得x=1.2mol。B的转化率为0.4。
考点: 勒沙特列原理 化学平衡状态的标志 化学平衡常数 转化率


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
①通过分析上图,可以得出对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号) 。
| A.该反应为放热反应 |
| B.T1时的反应速率大于T2时的反应速率 |
| C.该反应在T1时的平衡常数比T2时的大 |
| D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=_____。
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。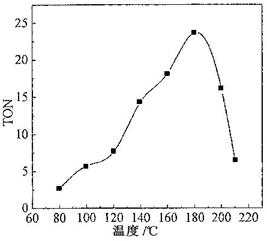
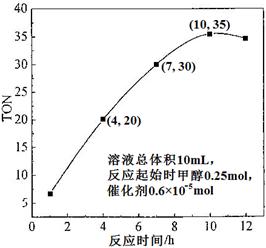
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(下图),判断下列说法正确的是___ __。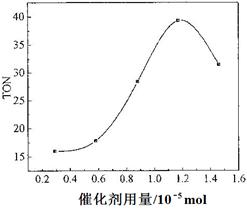
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘及其化合物在生产、生活中具有广泛的用途。解答下列与碘元素有关的试题:
(1)碘是人体中的微量元素之一,是一种智力元素。国家推广“加碘食盐”,其中一般加入的是KIO3,而不是KI。其原因是 。
(2)常温下,NH4I是一种固体,一定温度下在密闭容器中发生下面的反应:
① NH4I(s) 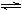 NH3(g) + HI(g)
NH3(g) + HI(g)
② 2HI(g) 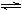 H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,缩小容器体积,增大体系压强,混合气体的颜色 (填“加深”或“变浅”或“不变”);达到平衡时,反应②的化学平衡常数表达式为 ;达到平衡时c(H2)=0.5mol/L,反应①的化学平衡常数为20,则 c (HI) = 。
(3)如图,在粗试管中加入饱和的KI溶液,然后再加入苯,插入两根石墨电极,接通直流电源。连接电源负极的电极为 极,电极反应式为 。通电一段时间后,断开电源,振荡试管,上层溶液为 色。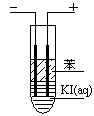
(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2饱和溶液的试管中,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色浑浊产生,这些黄色浑浊的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g) +H2O (g) H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K= ,ΔH= 0(填“<”、“>”、“=”)
(2)已在一定温度下,C(s) +CO2 (g) 2CO (g)平衡常数K1;
2CO (g)平衡常数K1;
C (s) +H2O(g) CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时间后反应达到平衡,此时CO的转化率为 :若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,此时v正 v逆 (填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
T℃时,A、B、C三种气体在反应过程中的浓度变化如图1所示,若保持其它条件不变,温度分别为T1℃和T2℃时,B的浓度变化与时间的关系示意图如图2所示。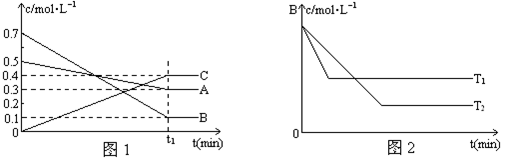
请回答下列问题:
(1)该反应的化学反应方程式是:
(2)比较大小:
A和B的转化率A B,原因是
温度的高低T1 T2,判断依据是
(3)若其它条件不变,反应进行到(t1+10)min时,A的浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系: Cr2O72- + H2O  2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈____色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈 色, 因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡 ,溶液颜色将 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H=" -574" kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H=" -1160" kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____ ;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tA tC(填 “>”、“<”或“=”)。
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是 ,曲线II对应的实验条件改变可能是____ 。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把3molA和2.5molB混合于2L密闭容器中,发生反应:
3A(g)+B(g) xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
(1) x= ;
(2) 平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com