
利用100mL0.50 mol·L-1 Na2CO3溶液配制Na+浓度为0.20 mol·L-1的溶液,下列操作正确的是
A.将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
B.将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌
C.将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌
D.将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀
科目:高中化学 来源:2016届山东省高三上学期12月质检化学试卷(解析版) 题型:填空题
自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是_________________。
(2)NH3在一定条件下可被氧化.
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
ⅱ.
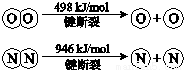
①断开1mol H-O 键与断开 1mol H-N 键所需能量相差约_________kJ;
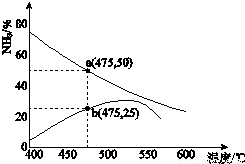
(3)下图是某压强下,N2与H2按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线.其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线.
②H-O 键比H-N键(填“强”或“弱”)_____;
①图中b点,v(正)_____v(逆).(填“>”、“=”或“<”)
②图中a点,容器内气体n(N2):n(NH3)=_____。
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是_______________。
(5)电解法能将碱性溶液中的NO2-转化为N2而除去,其电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是③>②>①
B.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
C.若将3种溶液稀释相同倍数,pH变化最大的是②
D.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上二次月考化学试卷(解析版) 题型:选择题
下列事实中不能用勒夏特列原理加以解释的是( )
A.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.夏天,打开啤酒瓶时会在瓶口逸出气体
D.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH- NH3↑+H2O
NH3↑+H2O
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4NH3·H2O=[Al(OH)4]—+4NH4+
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH)。下列判断正确的是( )
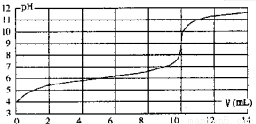
A.HA的浓度为1×10-4mol•L-1 B.实验时可选甲基橙作指示剂
C.pH=7时,溶液中c(Na+)>c(A-) D.V=10mL,酸碱恰好中和
查看答案和解析>>
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关物质的分类或归类正确的是
①混合物:波尔多液、盐酸、水银
②化合物:氯化钾、甲烷、HD
③电解质:明矾、胆矾、硫酸钡
④非电解质:酒精、CO2、Cl2
⑤同位素:12C、13C、14C
A.③④ B.③⑤ C.②③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lgV/V0的变化如图所示,下列叙述错误的是( )
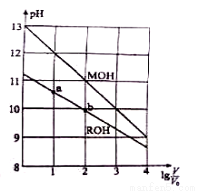
A.ROH的电离方程式为ROH=R++OH-
B.ROH的电离程度:b点大于a点
C.等pH的ROH和MOH溶液,则MOH的浓度低
D.当lgV/V0=2时,若两溶液同时升高温度,则
C(R+)增大,C(M+)不变。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料,其制取原理为:
Al2O3+3C+N2 2AlN+3CO。在制取氮化铝时由于反应不完全,产品中有氧化铝和碳。
2AlN+3CO。在制取氮化铝时由于反应不完全,产品中有氧化铝和碳。
为了分析某AlN样品的组成,某实验小组进行了如下探究。
【实验1】测定样品中氮元素的质量分数。
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
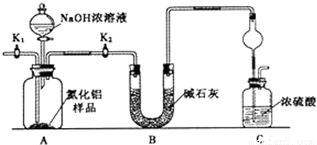
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(1)如图C装置中球形干燥管的作用是__________________________。
(2)完成以下实验步骤:组装好实验装置,首先___________,再加入实验药品.然后______,
打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,缓缓通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是__________。
(3)若去掉装置B,则导致测定结果____________(填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见_______________________。
【实验2】按以下步骤测定样品中铝元素的质量分数。
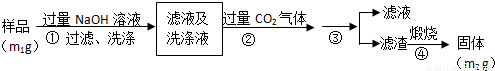
(4)步骤②生成沉淀的离子方程式为___________________。
(5)操作③需要的玻璃仪器有__________________________。
(6)A1元素的质量分数为________(用m1、m2表示)。
【实验3】测定样品中碳元素的质量分数。
称取10.00g样品置于反应器中,通往2.24LO2,在高温下充分反应后得到3.36L气体(AlN不跟O2反应),测得其密度为1.61g•L-1(体积及密度均已换算成标准状况)。
(7)计算该样品中碳元素的质量分数_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com