
下列说法正确的是( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
C.稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
科目:高中化学 来源: 题型:
从下列事实,找出不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡: ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对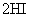

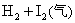 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应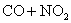

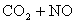 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应: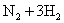

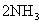 ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.00 mol二氧化硫和1.00 mol氧气通入1.00 L的密闭容器中,分别在500 K,600 K,700 K三个不同的温度下进行2SO2+O2 2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.10 | 0.15 | 0.20 | 0.25 | 0.30 |
| 时间 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3浓度(mol·L-1) | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
表二:600 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.20 | 0.30 | 0.40 | 0.50 | 0.50 |
表三:700 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
(1)从上面三个表的数据可以判断该反应是__________反应(填“吸热”或“放热”),利用表一计算0~40 min内用SO2表示该反应的化学反应速率v(SO2)=__________mol·L-1·min-1。
(2)对该反应,下面的说法正确的是__________。
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500 K平衡状态时升高温度至600 K时,重新达到平衡状态时,容器的压强减小
(3)从上面三个表的数据,温度对该反应的反应速率和平衡移动的影响是_____________________________________________________________________。
(4)计算在600 K时的平衡常数(写出计算过程,最后结果取两位有效数字)。
(5)下图曲线(Ⅰ)是在500 K时SO3浓度的变化曲线,请你在图中画出在550 K进行上述反应的曲线,并标明曲线(Ⅱ)。
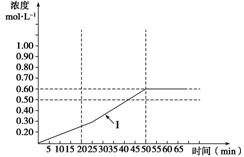
查看答案和解析>>
科目:高中化学 来源: 题型:
有关化学用语正确的是 ( )
A.乙烯的结构简式CH2CH2 B.乙醇的结构简式C2H6O
C.四氯化碳的结构式CCl4 D.乙酸的分子式C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于蛋白质的叙述正确的是 ( )
A.天然蛋白质的组成元素只有磷、氢、氧、氮
B.加热会使蛋白质变性,因此食生鸡蛋的营养价值更高
C.向鸡蛋中加食盐,会使蛋白质凝固变性
D.用一束光照射蛋白质溶液,可以产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是 ( )
A.植物油不能发生水解反应 B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应 D.蛋白质水解的产物为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
 4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示 H,则
H,则 H=____________________;
H=____________________;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为________________________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)_____ Ni2+ + ____ H2PO2-+ _____ → ___Ni++______ H2PO3-+ ____
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:______________________________________________________;
原理上的不同点:______________________________________________________;
化学镀的优点:________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com