
| A、氯化铁溶液中加入还原性铁粉 | B、硫酸铁溶液中滴加硫氰化钾溶液 | C、碘水中滴加淀粉碘化钾溶液 | D、碳酸氢钠溶液中滴加稀盐酸 |


科目:高中化学 来源: 题型:
| A、丙烯和乙烯、丁二烯互为同系物 | B、丙烯与环丙烷互为同分异构体 | C、丙烯的沸点大于乙烯 | D、理论上,等质量的聚丙烯和丙烯完全燃烧消耗的氧气相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在钠、钾、铷,三种单质中,铷的熔点最高 | B、充电电池的化学反应原理是氧化还原反应,充电是使放电时的氧化还原反应逆向进行,燃料电池的能量利用率可达100% | C、化学键可以使离子相结合,也可以使原子相结合 | D、氟利昂-12(CF2Cl2)有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 相同条件下NaHCO3的溶解度比Na2CO3的小 | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 |
| B | 钠比铜活泼 | 金属钠可从硫酸铜溶液中置换出铜单质 |
| C | 常温下铝与浓硫酸、浓硝酸均不反应 | 可用铝槽车密封运送浓硫酸、浓硝酸 |
| D | 合成氨反应为吸热反应 | 该反应需在高温条件下进行 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是高科技的支柱材料,可用于制备太阳能电池板和光导纤维 | B、用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯可以延长水果的保存期 | C、绿色化学的核心是利用化学原理对环境污染进行治理 | D、明矾常用作净水剂,目的是除去水中的悬浮杂质和有害细菌 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2 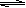 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
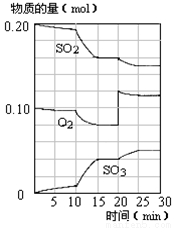
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
下列表述正确的是
A.氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B.在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:实验题
(16分)Ⅰ、亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
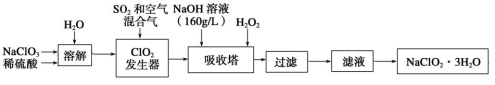
已知:
① NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
② 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③ 160 g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1 L。
(1)160 g/L NaOH溶液的物质的量浓度为: (结果保留三位有效数字)
(2)发生器中鼓入空气的作用是: 。
(3)写出吸收装置内发生反应的化学方程式,并标出电子转移方向和数目: ;吸收装置中的温度不能过高,其原因是: 。
(4)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是_____(选填序号)
a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
Ⅱ、在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 KOCN + 2KCl + H2O
KOCN + 2KCl + H2O
再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:
____ KOCN + ____ KOH + ____Cl2 ____ CO2 + ____ N2 + ____ KCl + ____H2O
____ CO2 + ____ N2 + ____ KCl + ____H2O
(2)实验室用MnO2与浓HCl制取Cl2, 在答卷上画出虚线框内制取Cl2的装置图,并标出实验药品。
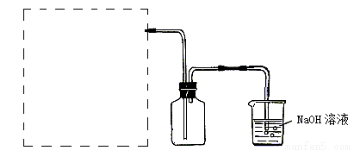
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com