
【题目】按要求回答下列问题:
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为______________。
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)________(填“>”“<”或“=”)c(HB)。
②混合溶液中c(HB)+c(B-)________(填“>”“<”或“=”)2c(Na+)。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
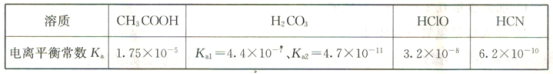
①同物质的量浓度的CH3COONa、NaClO、NaCN溶液中阴离子(不含OH-)浓度大小关系为____________。
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是________(填字母)。
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=____________(用数值列出计算式即可) mol·L-1。
【答案】![]() > = CH3COO->ClO->CN- a 2×10-6-2×10-8
> = CH3COO->ClO->CN- a 2×10-6-2×10-8
【解析】
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,说明该盐属于强碱弱酸盐,水解显碱性,据此进行分析离子浓度大小关系;
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合后溶液中的溶质为NaB和HB,且其物质的量之比为1:1;溶液中存在电荷守恒:![]() ,因为c(Na+)<c(B-),故c(H+)>c(OH-)溶液显酸性;因为题目中问到了c(HB),故HB为弱酸;
,因为c(Na+)<c(B-),故c(H+)>c(OH-)溶液显酸性;因为题目中问到了c(HB),故HB为弱酸;
(3)弱酸的电离平衡常数越大,酸性越强,其酸根阴离子的水解程度越弱。
(1)Na2A溶液pH=8,说明存在水解,Na2A溶液中存在的电离:![]() ;
;![]() (微弱);Na2A溶液中存在的水解:
(微弱);Na2A溶液中存在的水解:![]() ;
;![]() ;Na2A溶液中各离子的浓度大小关系为:
;Na2A溶液中各离子的浓度大小关系为:![]() ;
;
(2)①溶液存在电离:![]() ;同时存在水解
;同时存在水解![]() ;根据溶液显酸性可知电离程度大于水解程度,所以c(B-)>c(HB)故答案为:>;
;根据溶液显酸性可知电离程度大于水解程度,所以c(B-)>c(HB)故答案为:>;
②根据物料守恒可知c(HB)+c(B-)=2c(Na+),故答案为:=;
(3)①根据图表提供信息可知电离平衡常数:CH3COOH>HClO>HCN;故水解程度:CH3COONa<NaClO<NaCN,所以阴离子(不含OH-)浓度大小关系为CH3COO->ClO->CN-,故答案为:CH3COO->ClO->CN-;
②加水稀释时酸性越弱pH值变化越小,故答案为:a;
③根据常温下pOH=8,可知c(OH)=1×10-8 mol·L-1,c(H+)=1×10-6 mol·L-1;溶液中的电荷守恒为:![]() ;物料守恒为:
;物料守恒为:![]() ;相减消去钠离子可得:
;相减消去钠离子可得:![]() ,故答案为: 2×10-6-2×10-8。
,故答案为: 2×10-6-2×10-8。


科目:高中化学 来源: 题型:
【题目】I某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用![]() 10mL H2O2制取
10mL H2O2制取![]() 150mL O2所需的时间(秒)
150mL O2所需的时间(秒)
|
|
|
|
|
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
①该研究小组在设计方案时,考虑了温度、________、催化剂等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响: _____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的布条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
实验结果说明催化剂作用的大小与_________________________有关。
Ⅱ![]() 在体积为2L的密闭容器中充入1molH2 (g)和1molI2 (g),在一定温度下发生下列反应:
在体积为2L的密闭容器中充入1molH2 (g)和1molI2 (g),在一定温度下发生下列反应:![]()
![]()
![]() ,回答下列问题:
,回答下列问题:
(1)保持容器体积不变,向其中充入1molHI(g),反应速率_________(填“加快”“减慢”或“不变”)。
(2)保持容器内气体压强不变,向其中充入1mol氦气,反应速率_________________。(填“加快”“减慢”或“不变”)。
(3)反应进行到2min,测得容器内HI的浓度为0.2mol/L,用H2表示前2min该反应的平均化学反应速率为________________________,此时I2的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭是重要的化工原料,但属于不可再生能源,高效、清洁地利用煤炭资源至关重要。请回答下列问题:
(1)煤的气化。原理是C(s)+2H2(g)![]() CH4(g) ΔH。
CH4(g) ΔH。
在1L密闭容器中投入1mol碳,并充入2molH2,测得相关数据如图所示。
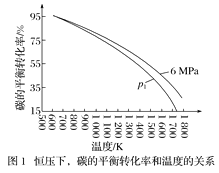

①有关图1、图2的说法正确的有___(填字母)。
a.p1<6MPa b.T1<1000K
c.ΔH<0 d.工业生产中,当温度为T2时,压强越高,经济效益越好
②图2中A点对应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)煤生产水煤气和半水煤气。
①工业上用煤生产作为合成氨原料气的水煤气,要求气体中(CO+H2)与N2的体积之比为3.1~3.2,发生的反应有C(s)+H2O(g)![]() CO(g)+H2(g),C(s)+
CO(g)+H2(g),C(s)+![]() O2(g)
O2(g)![]() CO(g)。从能量角度考虑,通入空气的目的是___。
CO(g)。从能量角度考虑,通入空气的目的是___。
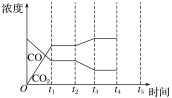
②如图是反应CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是______(填字母)。
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g)![]() 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
则反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
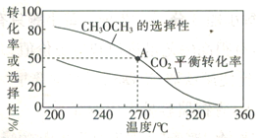
①CH3OCH3的选择性随温度的升高而降低的原因是___________,温度高于300℃时,CO2的平衡转化率随温度的升高而增大的原因是____________。
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=_________mol,反应I的化学平衡常数K=___________(保留两位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为__________(填“阴极”或“阳极”),生成C2H4的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
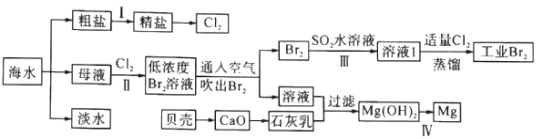
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中依次加入过量BaCl2、Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_____________。
(2)海水提溴,制得1mol Br2至少需要消耗_________mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为__________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)判断Mg(OH)2是否洗涤干净的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PTT纤维综合了尼龙的柔软性、腈纶的蓬松性、涤纶的抗污性,加上本身固有的弹性,以及能常温染色等特点,把各种纤维的优良性能集于一身,从而成为当前国际上最新开发的热门髙分子新材料之一。下面是制备PTT的一种线路:
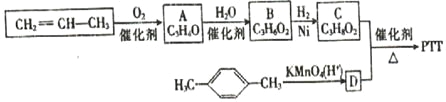
巳知:①A、B、C均为链状化合物,A能发生银镜反应,B结构中含有两种含氧官能团;
②C的核磁共振氢谱表明其有三种不同化学环境的氢,且峰面积之比为1 :2 :1
③1 mol D与足量碳酸氢钠溶液反应可生成2 mol CO2。
(1)B所含官能团的名称是________,A的结构简式是_______.
(2)C的系统名称是_________,写出与C含有相同官能团的C的一种同分异构体的结构简式:_____________。
(3)写出下列反应的反应类型:A→B____________,C+D→PTT_______________.
(4)C与D反应生成PTT的化学方程式是______________________.
(5)分子式为C4H6O且与A互为同系物的同分异构体有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
 +HCl
+HCl
下列有关叙述正确的是
A.I的分子式为C9H10O4
B.II中所有原子有可能均共面
C.可用FeCl3溶液鉴别有机物I和III
D.1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯(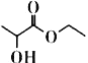 )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有 (不考虑空间异构) ( )
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有 (不考虑空间异构) ( )
A.8种B.10种C.12种D.14种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com