
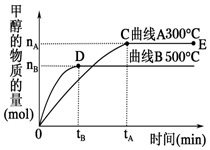
 一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡常数K(300℃)<K(500℃) | |
| B. | 500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{nB}{3tB}$ mol•L-1•min-1 | |
| C. | 在其他条件不变的情况下,将处于E点的体系的容积压缩到原来的$\frac{1}{2}$,氢气的浓度减小 | |
| D. | 300℃,当容器内压强不变时说明反应已经达到平衡 |
分析 A、根据温度对化学平衡的影响,温度升高,平衡向吸热方向移动分析;
B、先根据图象计算甲醇的平均反应速率,同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比;
C、增大压强,平衡向气体体积减小的方向移动;
D、该反应是一个反应前后气体体积改变的反应,当反应达到平衡状态时,混合气体的压强不变.
解答 解:A、反应CO(g)+2H2(g)?CH3OH(g)△H<0,升高温度,平衡逆向移动,K变小,K(300℃)>K(500℃),故A错误;
B、500℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=$\frac{nB}{3tB}$mol/(L•min),同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比,所以v(H2)=$\frac{2nB}{3tB}$mol/(L•min),故B错误;
C、增大压强,平衡向气体减小的方向移动,但氢气的物质的量减小程度小于体积减小程度,所以氢气的物质的量浓度增大,故C错误;
D、该反应是一个反应前后气体体积改变的反应,但反应达到平衡状态时,各种气体的物质的量不变,则混合气体的压强不变,故D正确;
故选D.
点评 本题考查了物质的量随时间变化曲线,根据压强和温度对化学平衡的影响、反应速率公式等来分析解答,注意增大压强时,平衡向正反应方向移动,但氢气、一氧化碳浓度增大,为易错点.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
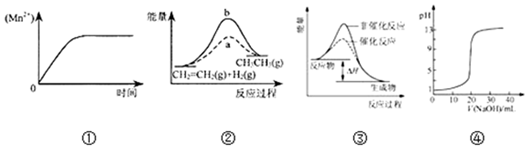
| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物 | |
| B. | 维生素C溶于水,溶液显酸性 | |
| C. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| D. | 含维生素C能使蓝色的碘的淀粉溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com