
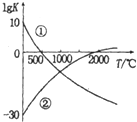
 氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:| A. | 反应①和②均为放热反应 | |
| B. | 升高温度,反应①的反应速率减小 | |
| C. | 在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 | |
| D. | 在1000℃时,反应①和反应②体系中N2的浓度一定相等 |
分析 A、根据图象①可知温度越高,平衡常数越小,说明升高温度,平衡逆向移动,逆反应方向是吸热反应,则该反应的正反应是放热反应;②温度越高,平衡常数越大,说明升高温度,平衡正向移动,正反应方向是吸热反应;
B.升高温度,无论是放热反应还是吸热反应,反应速率都增大;
C.在常温下,根据平衡常数可知:利用反应①固氮和利用反应②固氮反应程度相差很大;
D.在1000℃时,反应①和反应②体系平衡常数对数值(IgK)相等.
解答 解:A、根据图象①可知温度越高,平衡常数越小,说明升高温度,平衡逆向移动,逆反应方向是吸热反应,则该反应的正反应是放热反应;②温度越高,平衡常数越大,说明升高温度,平衡正向移动,正反应方向是吸热反应,故A错误;
B.升高温度,无论是放热反应还是吸热反应,反应速率都增大,故B错误;
C.在常温下,根据平衡常数可知:利用反应①固氮和利用反应②固氮反应程度相差很大,故C正确;
D.在1000℃时,反应①和反应②体系平衡常数对数值(IgK)相等,而不是氮气的浓度相等,故D错误;
故选:C.
点评 本题考查温度对平衡的影响,学生要学会分析图象,要温度变化正逆反应速率都变化,掌握基础是关键,题目难度中等.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 常温下,准确称取14.8gCa(OH)2,配置100mL2.0mol/L的Ca(OH)2溶液 | |
| B. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,震荡,静置、分液,得下层液体 | |
| C. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去氯化钠中的泥沙-过滤 | |
| B. | 用四氯化碳提取溴水中的溴单质-萃取 | |
| C. | 分离汽油和水-分液 | |
| D. | 除去碳酸氢钠固体中的碳酸钠-加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
| D. | 分枝酸分子中含有2种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3 )2与澄清石灰水反应可以表示为:2Ca2++3HCO${\;}_{3}^{-}$+3OH-═2CaCO3↓+CO${\;}_{3}^{2-}$+3H2O | |
| B. | 用Pt电极电解少量的CuC12溶液:2H2O+Cu2++2Cl-═H2↑+Cl2↑+Cu(OH)2↓ | |
| C. | 向CuSO4,溶液中加人Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 向NaCIO和NaCI混合溶液中滴人少量FeSO4溶液:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
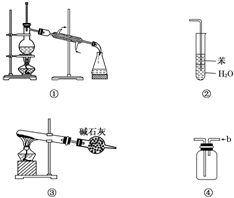
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气可收集H2、NO等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com