
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:

(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是_____________。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______________。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为![]() ,请写出尿素的同分异构体中含有离子键的化学式_________。
,请写出尿素的同分异构体中含有离子键的化学式_________。
(5)已知CO2+ 2NH3![]() CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
【答案】ac 2NH4HS+O2 2NH3·H2O+2S↓ 2CO2+6H2
2NH3·H2O+2S↓ 2CO2+6H2 CH3CH2OH+3H2O CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O NH4OCN 300
CH3CH2OH+3H2O CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O NH4OCN 300
【解析】
(1)改变外界条件可以使化学反应速率增大,如升高温度、增大压强、增大物质的浓度、使用催化剂等都可以使反应速率增大,故选ac。故答案为:ac;
(2)向NH4HS溶液中通入空气即与空气中的氧气反应,被氧气氧化为单质硫,吸收液再生即又可以得到氨水,反应物和产物都有,再根据氧化还原反应中得失电子守恒即可得到反应的化学方程式为:2NH4HS+O2![]() 2NH3·H2O+2S↓;故答案为:2NH4HS+O2
2NH3·H2O+2S↓;故答案为:2NH4HS+O2![]() 2NH3·H2O+2S↓;
2NH3·H2O+2S↓;
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式:2CO2+6H2 CH3CH2OH+3H2O ;
CH3CH2OH+3H2O ;
在CH3CH2OH、空气、氢氧化钾溶液的燃料电池中,CH3CH2OH被氧气氧化失去电子在负极上发生反应,但是由于电解质溶液是碱性的,所以在电极上得到的产物为CO32-。负极上的反应为:CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O;
故答案为:2CO2+6H2 CH3CH2OH+3H2O ;CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O;
CH3CH2OH+3H2O ;CH3CH2OH-12e-+16OH-= 2CO32-+11 H2O;
(4) 尿素中含有N元素,N元素形成的离子有NH4+或NO3—,在本物质中含有H原子数较多,O原子数较少,故只能形成铵盐,尿素的同分异构体中含有离子键的化学式:NH4OCN;故答案为:NH4OCN;
(5)根据原子守恒法得到:
 ,则m=
,则m=![]() =300t。
=300t。
故答案为:300。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:![]() 、
、![]() 、
、![]()
B.在含等物质的量的![]() 、
、![]() 、
、![]() 的溶液中加入Zn:
的溶液中加入Zn:![]() 、
、![]() 、
、![]() 、
、![]()
C.在含等物质的量的![]() 、KOH的溶液中通入
、KOH的溶液中通入![]() :
:![]() 、KOH、BaCO3、
、KOH、BaCO3、![]()
D.在含等物质的量的AlO2-、![]() 、
、![]() 溶液中,逐滴加入盐酸:
溶液中,逐滴加入盐酸:![]() 、
、![]() 、AlO2-、
、AlO2-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1molA和nmolB在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
A. 当n=2时,物质A、B的转化率之比为1: 2
B. 起始时刻和达到平衡后容器中的压强比为(1+n):(l+n-a/2)
C. 当v (A)正=2v (C)逆时,可断定反应达到平衡
D. 容器中混合气体的密度不再随时间改变而改变,反应到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) ![]() 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为
A. v (X)=0.05mol·L-1·min-1B. v (Z)= 0.10mol·L-1·min-1
C. v (Y)=0.10mol·L-1·min-1D. v (W)=0.05mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下式表示的氧化还原反应设计一个原电池:Zn(s) + Fe2+(aq) == Zn2+(aq) + Fe(s)
(1)装置采用烧杯和盐桥,画出此原电池装置的简图:____________
(2)注明外电路的电子流向____________
(3)写出2个电极上的电极反应_____________、_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂每小时生产a 吨98%(质量分数)硫酸。为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为___________m3。
(2)为满足题设要求,b%的下限等于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
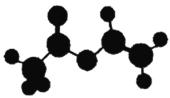
A.该化合物的名称为乙酸乙酯
B.该化合物与![]() 的四氯化碳溶液不反应
的四氯化碳溶液不反应
C.该化合物既能发生水解反应,又能发生缩聚反应
D.该化合物的链状同分异构体中,能与![]() 反应放出
反应放出![]() 的只有3种
的只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在298K、100 kPa时,已知:①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g) ![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
则△H1、△H2、△H3间的关系是_________,K1、K2、K3间的关系是___________。
II.高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。试回答下列问题:
Fe(s)+CO2(g) △H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将________填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时该化学反应的速度是v(正)______ v(逆)(填”>”、“<”、“=”),原因是________。
(4)保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值________0.263(填”>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
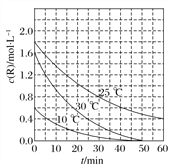
A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com