
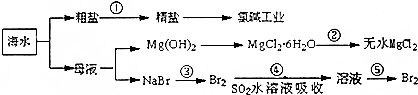
分析 根据转化图可知,①为粗盐提纯,粗盐精制得到精盐溶解制备饱和溶液,通电电解得到氢氧化钠溶液、氯气、氢气,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,②为氯化镁晶体在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴,步骤③氯气和溴离子反应生成溴单质;步骤④通过热空气吹出后用二氧化硫吸收得到溴离子,步骤⑤在氯水溶液中重新得到溴单质,据此回答.
(1)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
(2)氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应生成CaCl2、Ca(ClO)2、H2O;
(3)用SO2水溶液吸收Br2的反应发生氧化还原反应生成氢溴酸和硫酸.
解答 解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,选项中A符合题意,
故选A;
(2)氯气与石灰乳反应生成氯化钙和次氯酸钙,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-;
故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-.
点评 本题考查了海水资源及其综合利用,难点是除杂过程中加入药品的先后顺序,要根据物质的特点来分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
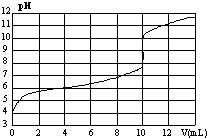 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | OH- | C. | S2- | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg和Zn | B. | Mg和Al | C. | Fe和Zn | D. | Cu和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
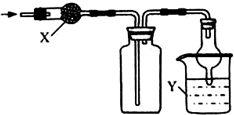
| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 无水氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 无水氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com