
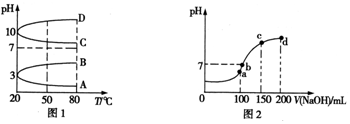
分析 (1)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极;
(5)放电时负极电极本身Al放电,失电子,根据AlCl4-和Al2Cl7-中铝元素和氯元素的比例来确定做AlCl4-做反应物而生成Al2Cl7-.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4Al(SO4)2中NH4+水解程度比NH4HSO4中的大,NH4Al(SO4)2溶液中c(NH4+)<NH4HSO4溶液中c(NH4+),
故答案为:<;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为A,故答案为:A;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1-10-11mol/L,故答案为:10-3-10-11;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,石墨做阴极,阳极反应为:Al-3e-=Al3+①,阴极上是来自于水的H+放电:2H2O+2e-=2OH-+H2↑ ②,将①×2+②×3可得总反应:2Al+6H2O$\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑,
故答案为:2Al+6H2O$\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑;
(5)放电时负极电极本身Al放电,失电子,由于AlCl4-中氯元素的含量高于Al2Cl7-中氯元素的含量,故AlCl4-做反应物而Al2Cl7-为生成物,由于其它离子不参与电极反应,故电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-,
故答案为:Al-3e-+7AlCl4-=4Al2Cl7-.
点评 本题考查了盐类水解、弱电解质电离平衡及其影响因素分析、溶液中离子浓度大小关系、原电池和电解池的原理应用,注意知识的迁移和原理的分析,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 水中含有的氧原子数约为6.02×1023 | |
| B. | 常温下,等物后的量的甲烷和一氧化碳所含有对分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气对质量小 | |
| D. | 气体摩尔体积是指1mol任何气体所占的体积,约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢是强电解质,醋酸是弱电解质,盐酸溶液的导电性一定强于醋酸溶液 | |
| B. | 不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性 | |
| C. | SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸 | |
| D. | 氯元素的非金属性强于碳元素,氯元素含氧酸的酸性都大于碳元素的含氧酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是纯净物,氢氧化铁胶体带正电 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 胶体属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 2 mol•L-1氯化铵溶液 | ||
| C. | 150 mL 1 mol•L-1氯化钾溶液 | D. | 75 mL 1 mol•L-1氯化铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为1.1NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 2.3 g金属钠与O2完全反应,转移电子的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2═Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将pH=12的氨水加水稀释,稀释过程中溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 同浓度的醋酸钠和醋酸等体积混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃相同pH的①CH3COONa②NaHCO3③NaAlO2三种溶液中的c(Na+):①>②>③ | |
| D. | 浓度均为0.1mol•L-1的KHS和HCl等体积混合液中:c(HS-)+c(H2S)=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com