
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.82 |
| 0.1 |
| 0.82 |
| 0.1 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑ |
| B、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、氢氧化钡溶液与盐酸的反应:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
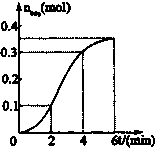 已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A、反应开始后2~4分钟内平均反应速率最大 |
| B、反应刚开始时反应速率较小,然后逐渐增大 |
| C、反应前阶段速率逐渐增大,是因为反应放热,使反应速率加快 |
| D、生成物CaCl2、CO2和H2O的总能量比反应物CaCO3和盐酸的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件① |
| 条件② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20℃,5mL,0.1 mol?L-1的硫酸 |
| B、20℃,4 mL,0.2 mol?L-1的硫酸 |
| C、30℃,3 mL,0.2 mol?L-1的硫酸 |
| D、30℃,4 mL,0.1 mol?L-1的硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2的生成速率与I2的生成速率相等 |
| B、反应容器内的压强不随时间的变化而变化 |
| C、H2、I2、HI的浓度相等 |
| D、若单位时间内生成n mol H2的同时生成2n mol HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com