
| A、甲烷的标准燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | ||
| B、稀HNO3溶液与NaOH溶液发生反应生成1 mol H2O时放出57.3 kJ的热量.其热化学方程式为:HNO3(l)+NaOH(l)=NaNO3(l)+H2O(l)△H=-57.3 kJ?mol-1 | ||
| C、若:2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=-Q kJ?mol-1.则:2H2S(g)+O2(g)═2S(s)+2H2O(g)△H<-Q kJ?mol-1 | ||
D、若:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ?mol-1;Na2O2(s)+CO2(g)═Na2CO3(s)+
|
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、微粒X2-与Y2+核外电子排布相同,离子半径:X2->Y2+ |
| B、人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料 |
| C、由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F |
| D、Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出:Be(OH)2+2OH-═BeO22-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(CH3)3CCH(CH3)2 |
| B、(CH3)3CCH2C(CH3)2 |
| C、(CH3)3CC(CH3)2CH2CH3 |
| D、(CH3)3CC(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+为正四面体形 |
| B、SO2为直线形 |
| C、HCN为平面三角形 |
| D、BF3为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
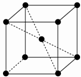 某晶体为体心立方晶格(如图),实验测得其密度为ρ(g?cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角线上的三个球相切.则该晶体晶胞的边长(cm)为( )
某晶体为体心立方晶格(如图),实验测得其密度为ρ(g?cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角线上的三个球相切.则该晶体晶胞的边长(cm)为( )A、
| |||||||||
B、
| |||||||||
C、
| |||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| C | D | |||
| A | B | E |
| A、元素B和E、B和D形成的化合物在固态时都属于分子晶体 |
| B、工业上可用A、D形成的化合物制取A的单质;B的单质在信息业有广泛用途 |
| C、与E同族的元素中,若简单阴离子的还原性越强,则该元素的最高价氧化物对应水化物的酸性也越强 |
| D、元素B的最简单氢化物分子的空间构型为正四面体,元素C的最简单氢化物的沸点比E的气态氢化物的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、431kJ |
| B、945.6 kJ |
| C、649 Kj |
| D、869 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
| B、浓硫酸沾到皮肤上时,可立即用干布拭干,然后用大量的水冲洗 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA |
| B、1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| C、质量a g的C2H4和C3H6的混合物中共用电子对数目为3a NA/14 |
| D、常温下,pH=13的NaOH溶液中含有OH一的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com