
| 10-14 |
| 0.1 |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| BaSO4(BaCO3) | ||
| FeSO4(CuSO4) | ||
| NaCl(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
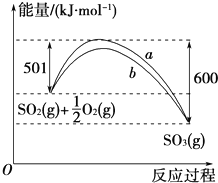 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molCl2参加反应转移电子数一定为2NA |
| B、标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA |
| C、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| D、标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18g/mol |
| B、CH4的摩尔质量为16g |
| C、3.01×1023个SO2分子的质量为32g |
| D、摩尔是国际单位制中的一个基本物理量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com