
【题目】有机物F(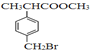 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
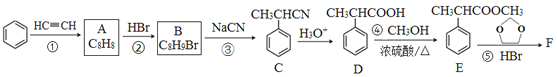
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。(无机试剂任选)
的合成路线_________________。(无机试剂任选)
【答案】![]() 16 酯基 ①②
16 酯基 ①② 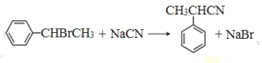 乙二醇
乙二醇 ![]()
【解析】
根据C的结构简式,逆推B是![]() ,A是苯乙烯;
,A是苯乙烯;
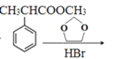
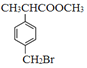 ,根据原子守恒,可知另一种产物是乙二醇,据此解答。
,根据原子守恒,可知另一种产物是乙二醇,据此解答。
(1)A是苯乙烯,结构简式为![]() ,分子中苯环、乙烯分别为2个平面,单键可旋转,所以所有原子可能处于同一平面,最多有16个原子共平面,故答案为:
,分子中苯环、乙烯分别为2个平面,单键可旋转,所以所有原子可能处于同一平面,最多有16个原子共平面,故答案为:![]() ;16;
;16;
(2)E中官能团名称是酯基,①~④分别是加成反应、加成反应、取代反应、取代反应,属于加成反应的是①②,故答案为:酯基;①②;
(3)反应③为-CN取代-Br,化学方程式为: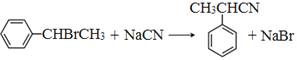 ,故答案为:
,故答案为: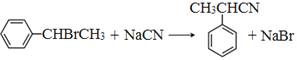 ;
;
(4)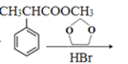
 ,根据原子守恒,可知另一种产物是乙二醇,故答案为:乙二醇;
,根据原子守恒,可知另一种产物是乙二醇,故答案为:乙二醇;
(5)![]() 与HCl发生取代反应生成
与HCl发生取代反应生成![]() ,
,![]() 与NaCN发生取代反应生成
与NaCN发生取代反应生成![]() ,
,![]() 水解为
水解为![]() ,最后
,最后![]() 与苯甲醇发生酯化反应生成
与苯甲醇发生酯化反应生成![]() ,所以合成路线为
,所以合成路线为![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁有如下δ、γ、α三种晶体结构,三种晶体在不同温度下能发生转化。下列说法不正确的是( )

A.δ、γ、α三种晶体互为同分异构体
B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个
C.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型不同,化学性质相同
D.γFe晶体为面心立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,我国科学技术名词审定委员会等单位正式发布115号等4种人工合成的新元素的名称、元素符号,115号元素名称为“镆”,符号为Mc。下列有关说法正确的是
A.Mc的最低负化合价为-3B.Mc的最高价氧化物的化式为Mc2O 5
C.![]() 的中子数为115D.通过化学反应可使
的中子数为115D.通过化学反应可使![]() 转化为
转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。
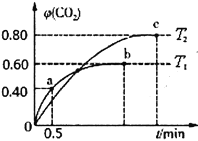
①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:Ni(OH)2+OH-—e-=NiO(OH)+H2O
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示,整辆“纳米车”的对角线的长度仅为3至4纳米),每 辆“纳米车”是由一个有机分子和四个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法不正确的是

A.人们用肉眼看不到“纳米车”的运动
B.“纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C.C60是一种新型的化合物
D.C60的摩尔质量为720gmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有广泛的应用,回答下列问题。
(1)实验室中常用浓盐酸和二氧化猛混合加热制备氯气,下列反应中盐酸所体现的性质与该反应相同的是________
a.Zn+2HCl=ZnCl2+H2↑
b.KClO3+6HCl=KCl+3Cl2↑+3H2O
c.2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
d.2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(2)向硫酸酸化的髙锰酸钾溶液中滴加H2O2溶液,高锰酸钾备液褪色并有气泡冒出,该反应中氧化剂与还原剂的物质的量之比为______,若生成标准状况下3.36 L气体时转移的电子数为________。
(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g)=CH3OH(l) △H=x
(1)己知常温下CH3OH、H2和CO的燃烧热分別为726.5kl/mo1、285.5kJ/mol、283.0kJ/mol,則x=_______;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应(CH3OH为气体),相关数据如图。

①该反应0-10min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是______(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为_______。相同条件下,若起始投料加倍,达平衡时,CO的体积分数将________(填“增大”、“减小”或“不变”)
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)表示平衡常数(以Kp表示),其中,PB=P总×B的体积分数;若在TK下平衡气体总压强xatm,则该反应Kp=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图,请分析lnK随T呈现上述变化趋势的原因是:____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com