
| A. | H+、S2O32-、SO42-、Na+ 能大量共存于同一溶液中 | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:Ba2+、Na+、ClO-、NO3-能大量共存 | |
| C. | 在含1mol FeI2的溶液中,通入1mol Cl2发生的离子反应为:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | |
| D. | 在NH4HSO4溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O |
分析 A.H+、S2O32-之间发生反应生成S和SO2;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液即显碱性,Ba2+、Na+、ClO-、NO3-与氢氧根离子不反应;
C.根据I-的还原性大于Fe2+判断;
D.在NH4HSO4溶液中滴加少量Ba(OH)2溶液,氢氧根离子只与氢离子反应,不与铵根离子反应.
解答 解:A.H+、S2O32-之间发生反应生成S和SO2,所以H+、S2O32-、SO42-、Na+ 不能大量共存于同一溶液中,故A错误;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液即显碱性,Ba2+、Na+、ClO-、NO3-与氢氧根离子不反应,则在该溶液下能大量共存,故B正确;
C.因为I-的还原性大于Fe2+,所以在含1mol FeI2的溶液中,通入1mol Cl2发生的离子反应为:2I-+Cl2═2Cl-+I2,故C错误;
D.在NH4HSO4溶液中滴加少量Ba(OH)2溶液,氢氧根离子只与氢离子反应,不与铵根离子反应,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D错误;
故选B.
点评 本题考查离子共存、离子方程式的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确判断离子能否共存的常用方法,本题需要注意从“评价、相关离子方程式”两个方面分析,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船的船体外侧镶嵌一定量的锌块,可以减缓轮船被腐蚀的速度,称之为牺牲阳极的阴极保护法 | |
| B. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| C. | 氢氧燃料电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| D. | 夏天雷雨过后空气特别清新是因为空气中产生了少量二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3molH2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | 2 c1>c3 | B. | a1+a3<1 | C. | 2 p2<p1 | D. | a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 放电过程 | 充电过程 |
| A | Li+向电池的正极迁移 | 化学能转化成电能 |
| B | 可以加入磷酸以提高电解质的导电率 | 阳极的电极反应式为LiFePO4-e-═FePO4+Li+ |
| C | 若正极增加7g,则有NA个电子经电解质由负极流向正极 | 阳极材料的质量不断减少 |
| D | 若有n molLi+迁移,则理论负极失去nmol电子 | 阴极的电极反应式为Li++e-═Li |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 沼气是可再生资源,电能是二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的种类很多,但它们水解后都一定有一产物相同 | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 聚乙烯、蛋白质和纤维素都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 结论 | |
| A. | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
| B. | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| C. | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
| D. | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
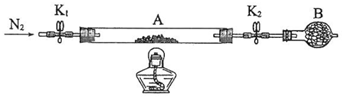
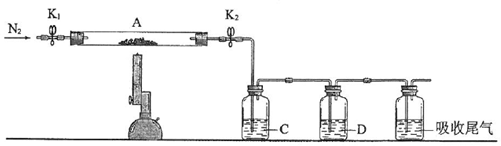
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com